
【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
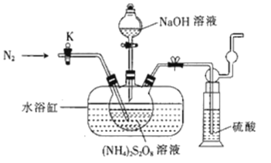
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。
【答案】分液漏斗 将三颈烧瓶中产生的NH3及时排出,减少副反应的发生 2![]() -2e- ==
-2e- ==![]() Na2S2O8+2H2O==H2SO4+Na2SO4+ H2O2 碱性 2H2O2
Na2S2O8+2H2O==H2SO4+Na2SO4+ H2O2 碱性 2H2O2![]() 2H2O+O2↑ 当滴入最后一滴H2O2溶液时,溶液由紫色变为无色,且在半分钟内不变色 5.68×10-3V1
2H2O+O2↑ 当滴入最后一滴H2O2溶液时,溶液由紫色变为无色,且在半分钟内不变色 5.68×10-3V1
【解析】
(1)~(3)(NH4)2S2O8溶液和一定浓度的NaOH溶液混合,发生复分解反应,生成Na2S2O8和NH3,由于发生副反应2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2,所以在反应过程中需不断往反应液中通N2将NH3尽快排出,以减少副反应的发生;也可用电解法制(NH4)2S2O8,在阳极
6Na2SO4+6H2O+N2,所以在反应过程中需不断往反应液中通N2将NH3尽快排出,以减少副反应的发生;也可用电解法制(NH4)2S2O8,在阳极![]() 被氧化为
被氧化为![]() ;
;![]() 在水溶液中能发生一定程度的水解,生成
在水溶液中能发生一定程度的水解,生成
H2SO4、Na2SO4和H2O2。
(4)在中性溶液中,煮沸后,![]() 能将Mn2+氧化为MnO2,MnO2促进H2O2分解生成O2;在碱性溶液中,
能将Mn2+氧化为MnO2,MnO2促进H2O2分解生成O2;在碱性溶液中,![]() 能将Mn2+逐渐氧化为MnO2,煮沸后继续氧化生成
能将Mn2+逐渐氧化为MnO2,煮沸后继续氧化生成![]() ;在酸性溶液中,
;在酸性溶液中,![]() 未将Mn2+氧化,只是煮沸后H2O2分解生成O2。
未将Mn2+氧化,只是煮沸后H2O2分解生成O2。
(1)图中装有NaOH溶液的仪器的名称为分液漏斗;依分析可知,为防NH3被氧化,应将生成的NH3从反应装置内尽快排出,所以反应过程中持续通入氮气的目的是将三颈烧瓶中产生的NH3及时排出,减少副反应的发生。答案为:分液漏斗;将三颈烧瓶中产生的NH3及时排出,减少副反应的发生;
(2)电解时,由![]() 生成
生成![]() ,O元素的价态部分升高,所以电解时阳极的电极反应式:2
,O元素的价态部分升高,所以电解时阳极的电极反应式:2![]() -2e- ==
-2e- ==![]() 。答案为:2
。答案为:2![]() -2e- ==
-2e- ==![]() ;
;
(3)另一种常温下为液态且具有强氧化性的物质应为H2O2,则最终仅生成H2SO4、Na2SO4H2O2,该反应的化学方程式:Na2S2O8+2H2O==H2SO4+Na2SO4+ H2O2。答案为:Na2S2O8+2H2O==H2SO4+Na2SO4+ H2O2;
(4)①由信息知,在碱性溶液中,![]() 能将Mn2+逐渐氧化为MnO2,煮沸后继续氧化生成
能将Mn2+逐渐氧化为MnO2,煮沸后继续氧化生成![]() ;所以在碱性条件下,Na2S2O8的氧化能力最强。答案为:碱性;
;所以在碱性条件下,Na2S2O8的氧化能力最强。答案为:碱性;
②中性氧化时,会产生大量气泡,其原因为2H2O2![]() 2H2O+O2↑。答案为:2H2O2
2H2O+O2↑。答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
③碱性氧化反应后的溶液为NaMnO4,呈深紫色,滴定终点时生成无色的Mn2+,所以滴定终点时的现象为当滴入最后一滴H2O2溶液时,溶液由紫色变为无色,且在半分钟内不变色;达到滴定终点时,依据关系式5H2O2~2![]() ,可求出n(
,可求出n(![]() )=
)=![]() ,m(
,m(![]() )=
)=![]() =5.68×10-3V1g。答案为:当滴入最后一滴H2O2溶液时,溶液由紫色变为无色,且在半分钟内不变色;5.68×10-3V1。
=5.68×10-3V1g。答案为:当滴入最后一滴H2O2溶液时,溶液由紫色变为无色,且在半分钟内不变色;5.68×10-3V1。


科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.用化学平衡移动原理的知识可以解释用排饱和食盐水收集Cl2的原因
B.工业上合成氨,平衡时将氨气液化分离,平衡向右移动,有利于提高H2的转化率
C.在硫酸工业中,三氧化硫的吸收阶段,吸收塔里要装填瓷环,以增大气液接触面积,使SO3的吸收速率增大
D.汽车尾气中的NO和CO缓慢反应生成N2和CO2,为加快该化学反应的速率,最符合实际的措施是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4又称为磁性氧化铁,常用来制造录音磁带和电讯器材。其Fe(II)和Fe(III)的比值是评判磁粉质量优劣的重要指标,测定方法如下(杂质不含干扰测定):
I.准确称量mg磁粉样品溶于过量稀硫酸,配制成250.00mL溶液;
II.取25.00mL上述溶液,用0.0200mol/LKMnO4溶液滴定,消耗KMnO4溶液V1mL;
III.另取I溶液25.00mL,加入30%过氧化氢溶液,微热至无气泡后冷却至室温;
IV.向Ⅲ所得溶液中加入过量KI,密闭反应30min;
V.用0.3000mol/LNa2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液V2mL。
已知:I2 + 2Na2S2O3 = 2NaI + Na2S4O6,Na2S2O3 和 Na2S4O6 溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、____________和______________。
(2)Ⅱ中发生反应的离子方程式是_____________。
(3)Ⅲ中加过氧化氢溶液时一定要过量,理由是______________。
(4)V 中滴定至终点的现象是_______________。
(5)磁粉中 Fe(II)和Fe(III)的物质的量之比为___________(写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
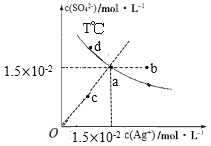
A.a点溶液加入硝酸银固体,则a点可沿虚线移动到b点
B.a点溶液若降低温度,则a点可沿虚线移动到c点
C.向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动
D.根据曲线数据计算可知,T℃下,Ksp(Ag2SO4)=2.25×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是( )
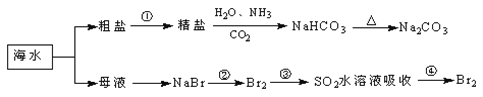
A. 除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤后加盐酸
B. 用澄清的石灰水不可鉴别NaHCO3和Na2CO3
C. 在第②、④步骤中,溴元素均被氧化
D. 从第②步到第④步的目的是为了富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似。
(1)写出硅烷的通式:____________。
(2)写出乙硅烷在空气中自燃的化学方程式:___________。
(3)甲硅烷的密度________(填“大于”、“小于”或“等于”)甲烷。
(4)甲硅烷的热稳定性________(填“大于”、“小于”或“等于”)甲烷。
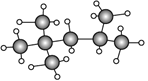
II.(1)某烃A的球棍模型如图所示,其分子式为:______,A的一氯代物有________种;B与A互为同系物,相对分子质量为58,请写出B的所有同分异构体的结构简式__________________。
(2)含有![]() 的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。广泛用作农用薄膜的聚氯乙烯塑料,是由CH2=CH—Cl聚合而成的,其化学反应方程式为______________________________________。
的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。广泛用作农用薄膜的聚氯乙烯塑料,是由CH2=CH—Cl聚合而成的,其化学反应方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精(75%乙醇)和84消毒液(主要成分是次氯酸钠)均能用于消毒。设NA为阿伏加德罗常数的值,下列说法正确的是
A.74.5g次氯酸钠中含有的分子数目为NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2 NA
C.46g医用酒精中含有碳碳键的数目为0.75 NA
D.1mol乙醇和1mol乙烯分别完全燃烧,消耗氧气的分子数均为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将![]() 转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
阳离子 | Fe3+ | Fe2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 9(>9溶解) | 8 |
(1)某含铬废水处理的主要流程如下图所示:

①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______________________________。
②请补充并配平以下反应池中发生主要反应的离子方程式:____![]() +____
+____![]() +____===____Cr3++____
+____===____Cr3++____![]() +____H2O。
+____H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-===H2O和_______________________________。证明Cr3+沉淀完全的方法是_____________________________________________________________。
(2)工业可用电解法来处理含![]() 的废水。实验室利用如图模拟处理含
的废水。实验室利用如图模拟处理含![]() 的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。

①Fe2+与酸性溶液中的![]() 反应的离子方程式是______________________________。
反应的离子方程式是______________________________。
② 若溶液中含有0.01 mol ![]() ,则阳离子全部生成的沉淀的物质的量是______mol。
,则阳离子全部生成的沉淀的物质的量是______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时间内生成n mo1 O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com