
【题目】下列说法错误的是
A.用化学平衡移动原理的知识可以解释用排饱和食盐水收集Cl2的原因
B.工业上合成氨,平衡时将氨气液化分离,平衡向右移动,有利于提高H2的转化率
C.在硫酸工业中,三氧化硫的吸收阶段,吸收塔里要装填瓷环,以增大气液接触面积,使SO3的吸收速率增大
D.汽车尾气中的NO和CO缓慢反应生成N2和CO2,为加快该化学反应的速率,最符合实际的措施是升高温度
【答案】D
【解析】
A.Cl2在水中存在平衡:Cl2+H2O![]() H++Cl-+HClO。若水中含有NaCl,则NaCl电离产生的Cl-使生成物的浓度增大,平衡逆向移动,可以减小Cl2的溶解及反应,故A正确;
H++Cl-+HClO。若水中含有NaCl,则NaCl电离产生的Cl-使生成物的浓度增大,平衡逆向移动,可以减小Cl2的溶解及反应,故A正确;
B. 减小生成物的浓度,平衡正向移动,工业上合成氨,平衡时将氨气液化分离,平衡向右移动,有利于提高H2的转化率,故B正确;
C. 增大接触面积加快反应速率,在硫酸工业中,三氧化硫的吸收阶段,吸收塔里要装填瓷环,以增大气液接触面积,使SO3的吸收速率增大,故C正确;
D. 汽车尾气中的NO和CO缓慢反应生成N2和CO2,为加快该化学反应的速率,最符合实际的措施是使用高效催化剂,故D错误;
答案选D。


科目:高中化学 来源: 题型:
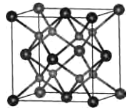
【题目】含铬化合物及铬合金用途非常广泛。回答下列问题:
⑴基态Cr原子价电子排布式为___;第三电离能I3(Cr)=2987kJ·mol-1,I3(Mn)=3248kJ·mol-1,I3(Cr)<I3(Mn),其原因是___。
⑵Cr-Ni-Si是具有八边形相的准晶体,准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___法区分晶体、准晶体和非晶体。
⑶已知反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+6NO2↑+16K2SO4+55H2O。
①根据价层电子对互斥理论,SO2、CO2、H2O的气态分子中,中心原子价层电子对数目依次为___、___、___。
②写出一种与SCN-互为等电子体的分子:___(填化学式)。
③KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为___,两个配体NH3、SCN-中,中心原子杂化类型依次为___、___。
⑷一种具有萤石结构的CrO2的晶胞结构如图所示,晶胞参数为apm。则两个氧原子间的距离为___pm,Cr-O键的键长为___pm;设NA为阿伏加德罗常数的值,则CrO2的密度为___g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)
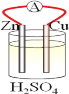
(1)负极是__________(填“铜”或“锌”),_________电子(填“失去”或“得到”),发__________(填“氧化”或 “还原”),电极反应方程式______________;
(2)电流由__________流向__________(填“铜”或“锌),铜片上观察到的现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是
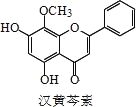
A.汉黄芩素的分子式为 C16H12O5
B.该物质遇 FeCl3 溶液显色
C.1 mol 该物质与溴水反应,最多消耗 2mol Br2
D.与足量 H2 发生加成反应后,该分子中官能团的种类减少 3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中设计两个关于NO的探究实验。
(一)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,探究NO和NH3能否反应。
(1)氨气的制备

①氨气的发生装置可以选择上图中的_____,反应的化学方程式______________________
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→__________(按气流方向,用小写字母表示)。
(2)将上述收集到的NH3加入少量催化剂,充入NO,充分混合,冷却到室温,观察到管中有少量水珠,说明NO和NH3能反应,则氧化剂和还原剂的物质的量之比为__________。
(二)探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O22NaNO2
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3 -。
回答下列问题:
(1)仪器a名称:________________ 。
(2)B瓶内装的物质是:_______________ 。
(3)若NO能被Na2O2完全吸收,E装置中的现象为 ______________ 。
(4)三颈烧瓶A中反应的化学方程式为____________________________。
(5)C装置的作用是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
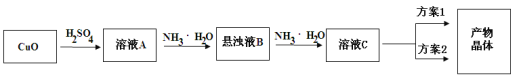
相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+ ![]() Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图
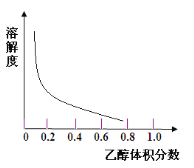
请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是_____。
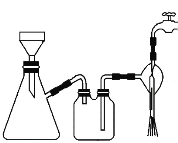
A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有_____杂质,产生该杂质的原因是______。
(2)方案2的实验步骤为:a.向溶液C中加入适量____,b.抽滤,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是________。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:____________。
③步骤d采用________干燥的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钢铁冶炼的说法错误的是( )
①焦炭在炼铁中的作用是产生还原剂和热量
②炼钢中用纯氧代替空气做氧化剂,是为了防止产生污染
③炼铁高炉有两个进口、三个出口
④用含硫较多的生铁炼钢,应加入较多的生石灰
⑤炼铁、炼钢过程中都发生CaO+SiO2![]() CaSiO3
CaSiO3
⑥尽管铁的熔点是1 535 ℃,但高炉中的铁在1 200 ℃左右就呈液态
⑦生铁炼钢的主要目的调节硅锰等的含量、除去硫磷
A. ①⑥ B. ②⑦ C. ③⑤ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
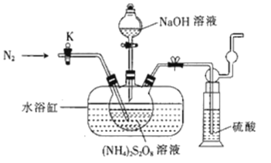
【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com