
【题目】医用酒精(75%乙醇)和84消毒液(主要成分是次氯酸钠)均能用于消毒。设NA为阿伏加德罗常数的值,下列说法正确的是
A.74.5g次氯酸钠中含有的分子数目为NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2 NA
C.46g医用酒精中含有碳碳键的数目为0.75 NA
D.1mol乙醇和1mol乙烯分别完全燃烧,消耗氧气的分子数均为3 NA
【答案】D
【解析】
A.次氯酸钠由Na+和ClO-构成,不存在分子,A错误;
B.NaClO+2HCl=NaCl+H2O+Cl2↑~1e-,故1mol次氯酸钠与足量盐酸反应转移的电子数为1 NA,B错误;
C.医用酒精为体积分数为75%的乙醇溶液,不是质量分数,现有条件无法计算乙醇的物质的量,也就无法计算碳碳键的数目,C错误;
D.由CxHyOz+(x+![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O可知,1mol乙醇(C2H5OH)完全燃烧消耗(2+
H2O可知,1mol乙醇(C2H5OH)完全燃烧消耗(2+![]() )mol=3molO2,1mol乙烯(C2H4)完全燃烧消耗(2+
)mol=3molO2,1mol乙烯(C2H4)完全燃烧消耗(2+![]() )mol=3molO2,即1mol乙醇和1mol乙烯分别完全燃烧,消耗氧气的分子数均为3 NA,D正确。
)mol=3molO2,即1mol乙醇和1mol乙烯分别完全燃烧,消耗氧气的分子数均为3 NA,D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】下列关于钢铁冶炼的说法错误的是( )
①焦炭在炼铁中的作用是产生还原剂和热量
②炼钢中用纯氧代替空气做氧化剂,是为了防止产生污染
③炼铁高炉有两个进口、三个出口
④用含硫较多的生铁炼钢,应加入较多的生石灰
⑤炼铁、炼钢过程中都发生CaO+SiO2![]() CaSiO3
CaSiO3
⑥尽管铁的熔点是1 535 ℃,但高炉中的铁在1 200 ℃左右就呈液态
⑦生铁炼钢的主要目的调节硅锰等的含量、除去硫磷
A. ①⑥ B. ②⑦ C. ③⑤ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述, 正确的是( )
A. 新制氯水中只含Cl2和H2O分子 B. 新制氯水只能使蓝色石蕊试纸变红但不褪色
C. 氯水经光照有气泡逸出,该气体是 HCl D. 氯水放置数天后 pH 将变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).
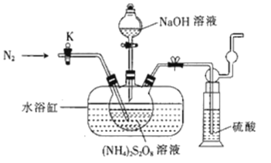
已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,请写出水蒸气分解的热化学方程式__________。
II.甲醇(CH3OH)广泛用作燃料电池的燃料,可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
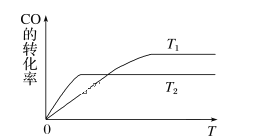
①T1____T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1____(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是______(填字母)。
a. 降低温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
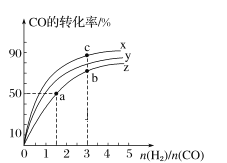
(2)在容积为1 L的恒容容器中,分别研究在300 ℃、350 ℃和370 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线x对应的温度是______℃;曲线z对应的温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中成药连花清瘟胶囊中有效成分为绿原酸。已知绿原酸存在如图转化,下列有关说法正确的是
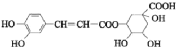 (绿原酸)
(绿原酸)![]()
 (化合物I) +
(化合物I) +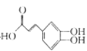 (化合物II)
(化合物II)
A.在反应①中,绿原酸与水按 1∶1 发生反应,则绿原酸的分子式为C16H20O10
B.1 mol化合物Ⅰ与足量金属钠反应生成氢气体积为56L
C.绿原酸、化合物I、化合物II均能发生氧化反应、取代反应、消去反应
D.化合物II中所有碳原子可能都共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol·L-1A气体和1mol·L-1B气体混合,并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质B表示的反应的平均速率为0.6mol·L-1·s-1
②用物质A表示的反应的平均速率为0.3mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是( )
A.① ③B.③ ④C.② ③D.② ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
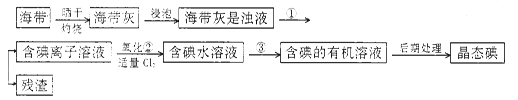
(1)指出提取碘的过程中有关的实验操作名称:①____________________;③______________。
若实验②中采用酸性条件下加入双氧水,则有关反应的离子方程式_________________________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A.甲苯,酒精B.四氯化碳,苯C.汽油,乙酸D.汽油,甘油
(3)含碘的有机溶液后期处理得到晶态碘需要进行的操作为___________;
最后,晶态碘在___________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列反应的叙述正确的是( )
A.由SiO2+2C![]() Si+2CO↑可推知硅的非金属性比碳强
Si+2CO↑可推知硅的非金属性比碳强
B.由CaCO3+SiO2![]() CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
C.由Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓可推知碳的非金属性比硅强
D.由Na2CO3+SiO2![]() Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com