
【题目】I.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,请写出水蒸气分解的热化学方程式__________。
II.甲醇(CH3OH)广泛用作燃料电池的燃料,可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
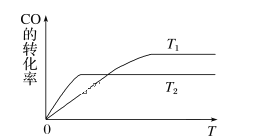
①T1____T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1____(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是______(填字母)。
a. 降低温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
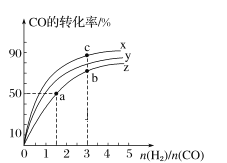
(2)在容积为1 L的恒容容器中,分别研究在300 ℃、350 ℃和370 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线x对应的温度是______℃;曲线z对应的温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________。
【答案】2H2O(g)=2H2(g)+O2(g) ΔH=+485 kJ·mol-1 < > cd 300 4 K1=K2<K3
【解析】
I.旧键断裂需要吸收能量,新键的生成会放出能量,△H=反应物的键能和-生成物的键能和;
II.(1)①据温度对化学平衡的影响来回答,先拐先平温度高T2>T1,CO转化率减小,说明升温平衡逆向进行,温度对化学平衡常数的影响和反应的吸放热有关,平衡逆向进行平衡常数减小;
②化学平衡正向移动可提高CO的转化率;
(2)正反应放热,则升高温度CO的转化率降低;计算出平衡时各物质的浓度,结合平衡常数的定义进行计算;平衡常数是温度的函数,正反应是放热反应,温度越高K越小。
I.旧键断裂需要吸收能量,新键的生成会放出能量,△H=反应物的键能和-生成物的键能和,△H=4×463kJ·mol-1-(2×436kJ·mol-1+495kJ·mol-1)=485kJ·mol-1,水蒸气分解的热化学方程式2H2O(g)=2H2(g)+O2(g) ΔH=+485 kJ·mol-1 ;
II.(1)①反应CO(g)+2H2(g)![]() CH3OH(g)中,反应向右进行,一氧化碳的转化率增大,温度升高,化学平衡向着吸热方向进行,根据图中的信息可以知道先拐先平温度高:T1<T2;
CH3OH(g)中,反应向右进行,一氧化碳的转化率增大,温度升高,化学平衡向着吸热方向进行,根据图中的信息可以知道先拐先平温度高:T1<T2;
温度越高CO转化率越小,说明升温平衡逆向进行,逆反应为吸热反应,所以正反应是放热反应,△H<0,对于放热反应,温度越高,平衡逆向进行化学平衡常数越小,因为图象分析可知T2>T1,所以K1>K2,
②a. 若容器容积不变,降低温度,反应CO(g)+2H2(g)![]() CH3OH(g)平衡正向移动,CO的转化率增大;
CH3OH(g)平衡正向移动,CO的转化率增大;
b. 将CH3OH(g)从体系中分离,平衡正向移动,CO转化率增大;
c. 使用合适的催化剂,平衡不移动,CO转化率不变;
d. 充入He,使体系总压强增大,但各组分的浓度不变,化学平衡不移动,CO的转化率不变;
故选cd;
(2)根据该反应为放热反应,温度越高CO的转化率越小,所以曲线x为300℃,
由图象可知当370℃时,CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)![]() CH3OH (g)
CH3OH (g)
起始(mol·L-1) 1 1.5 0
转化(mol·L-1) 0.5 1 0.5
平衡(mol·L-1) 0.5 0.5 0.5
K=c(CH3OH)/[c(CO)c2(H2)]=0.5/[0.5×0.52]=4,
曲线上a、b是等温,温度高于c点的温度,所以K1═K2<K3。


科目:高中化学 来源: 题型:
【题目】由两种元素组成的矿物A,测定A的组成流程如下:

请回答:
(1)②反应中除了产生D外,还有一种气体生成,请写出该气体的电子式____________
(2)写出①的化学方程式:_______________________________________________________
(3)写出③的离子方程式:____________________________________________________
(4)检验E溶液中含有Fe2+ 的方法是:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟氨催化氧化法制硝酸的装置如图所示。下列说法错误的是
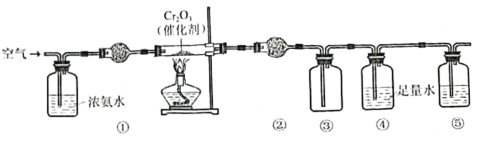
A.装置①、②、⑤依次盛装碱石灰、P2O5、NaOH溶液
B.装置③中产生红棕色气体
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D.通空气的主要作用是鼓出氨气,空气可用N2代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是( )
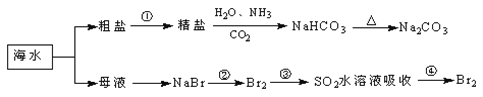
A. 除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤后加盐酸
B. 用澄清的石灰水不可鉴别NaHCO3和Na2CO3
C. 在第②、④步骤中,溴元素均被氧化
D. 从第②步到第④步的目的是为了富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精(75%乙醇)和84消毒液(主要成分是次氯酸钠)均能用于消毒。设NA为阿伏加德罗常数的值,下列说法正确的是
A.74.5g次氯酸钠中含有的分子数目为NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2 NA
C.46g医用酒精中含有碳碳键的数目为0.75 NA
D.1mol乙醇和1mol乙烯分别完全燃烧,消耗氧气的分子数均为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.FeSO4溶液与氨水反应的离子方程式:Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯与甲苯都是重要的有机化工原料.
(1)乙烯通入到Br2水中,现象是_____________.
(2)由甲苯获取食品香料添加剂苯甲酸苯甲酯,存在下列转化:
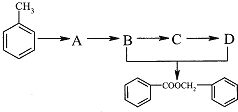
回答下列问题:
①C中的官能团名称____________,C→D的反应类型________________.
②B→C的化学方程式为________________.
③B+D→ ![]() 的化学方程式为_____________________.
的化学方程式为_____________________.
④A的化学式为C7H7Cl,则含有苯环的A的同分异构体还有______________种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com