
【题目】实验室模拟氨催化氧化法制硝酸的装置如图所示。下列说法错误的是
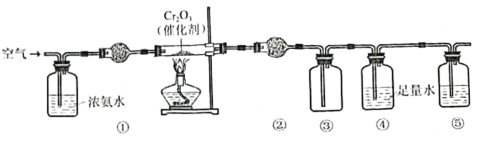
A.装置①、②、⑤依次盛装碱石灰、P2O5、NaOH溶液
B.装置③中产生红棕色气体
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D.通空气的主要作用是鼓出氨气,空气可用N2代替
【答案】D
【解析】
空气通入浓氨水后,氨气和氧气的混合气体经过碱性干燥剂干燥后进入装有催化剂的硬质玻璃管,发生催化氧化产生NO,生成的气体经过酸性干燥剂(或无水氯化钙),除去氨气和水蒸气,在装置③中NO与空气中的氧气反应生成NO2,并收集,④中的水可以吸收排出的二氧化氮产生硝酸,尾气中的NO2、NO在⑤中被吸收,防止污染,因此⑤中可以选用氢氧化钠溶液,以此解答该题。
A.根据上述分析,装置①、②、⑤可依次盛装碱性干燥剂、酸性干燥剂、NaOH溶液,碱石灰为碱性干燥剂,可以干燥氨气,P2O5属于酸性干燥剂可以吸收氨气并干燥,故A正确;
B.装置③中NO被氧化生成NO2,气体呈红棕色,故B正确;
C.装置④中发生3NO2+H2O=2HNO3+NO,溶液显酸性,可使紫色石蕊溶液变红,故C正确;
D.通空气的主要作用是鼓出氨气并提供氧气,空气不能用N2代替,故D错误;
故选:D。


科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学常见物质(纯净物或水溶液),其转化关系如下(部分反应物或产物未标出;反应条件未标出)。回答下列问题:
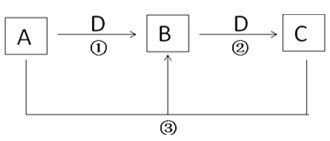
(1)若D为气体,在标况下的密度为1.964g·L-1;A为强碱溶液,其焰色反应为黄色,则反应②的化学方程式为_________________.
(2)若B为白色胶状沉淀,D为强碱溶液.则反应③的离子方程式为___________
(3)若A为黄绿色的气体,D为目前使用量最大的金属单质,则检验B物质中的阳离子时发生的离子方程式为_______________.
(4)若A为一种金属单质,常温下D浓溶液不能溶解A,D稀溶液能溶解A,但不产生H2.则反应②的离子方程式为_______________________.
(5)若D为O2,要实现上面的转化,A、C分别可以是________________(各填一种,填化学式) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(g);△H = —483.6kJ·mol-1,则氢气的燃烧热为241.8kJ
B.已知4P(红磷,s)=P4(白磷,s); △H >0,则白磷比红磷稳定
C.含2.0g NaOH的稀溶液与稀硫酸完全中和,放出2.87kJ的热量,则表示该反应中和热的热化学方程式为: NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(1); △H = —57.4kJ·mol-1
D.已知C(s)+O2(g)=CO2(g); △H1 C(s)+1/2O2(g)=CO(g); △H2 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学探究在实验室中![]() 检验的干扰因素。
检验的干扰因素。
(1)检验溶液中是否含有![]() 时先用过量盐酸将溶液酸化,其目的是排除_______________、
时先用过量盐酸将溶液酸化,其目的是排除_______________、![]() 、Ag+等离子可能造成的干扰。
、Ag+等离子可能造成的干扰。
(2)为了验证盐酸能否排除![]() 的干扰,该小组同学进行了如下实验:
的干扰,该小组同学进行了如下实验:
Ⅰ.量取一定体积的浓盐酸(盛放浓盐酸试剂瓶的标签中部分信息如下图),稀释,配制成 5 mol/L 的稀盐酸。

Ⅱ.甲同学取 0.3 g 未变质的 Na2SO3 固体,向其中加入上述 5mol/L 稀盐酸至过量,产生大量气泡。充分振荡后滴加 4 滴BaCl2 溶液,迅速产生白色浑浊,产生白色浑浊的原因可能是:
①______________。
②盐酸中含有 Fe3+,实验证实含有 Fe3+的方案是:___________________,用离子方程式解释由 Fe3+产生白色浑浊的原因:__________。
(3)乙同学提出,检验![]() 时能否用硝酸酸化来排除
时能否用硝酸酸化来排除![]() 的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
硝酸浓度(mol/L) | 滴加氯化钡溶液之前现象 | 滴加氯化钡溶液之后现象 |
15.0(浓硝酸) | 产生大量红棕色气体,溶液呈黄色 | 立即产生大量白色沉淀 |
7.5 | 产生大量红棕色气体,溶液呈淡黄色 | 立即产生大量白色沉淀 |
4.8 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 60 min 后溶液开始变浑浊 |
2.0 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 70 min 后溶液开始变浑浊 |
0.5 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 120 min 后溶液开始变浑浊 |
依据上述实验得出的结论是:________________。
(4)丙同学查阅资料后提出:Cl-的存在也会对![]() 的检验产生干扰。在 Cl-催化作用下,稀硝酸可将
的检验产生干扰。在 Cl-催化作用下,稀硝酸可将![]() 氧化为
氧化为 ![]() 。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
实验 | 实验操作 | 实验现象 |
ⅰ | 将 0.3 g Na2SO3 和 0.3 g NaCl 固体混合,加入 10 mL 2.0mol/L 的稀硝酸,振荡后,再滴加 4 滴 BaCl2 溶液。 | 立即产生大量白色沉淀。 |
ⅱ | ____________。 | 放置两小时后溶液未变浑浊。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述, 正确的是( )
A. 新制氯水中只含Cl2和H2O分子 B. 新制氯水只能使蓝色石蕊试纸变红但不褪色
C. 氯水经光照有气泡逸出,该气体是 HCl D. 氯水放置数天后 pH 将变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c)、υ(b)>υ(d)
C.平衡常数:K(a)>K(c)、K(b)>K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,请写出水蒸气分解的热化学方程式__________。
II.甲醇(CH3OH)广泛用作燃料电池的燃料,可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
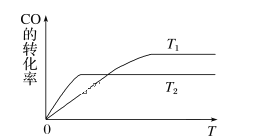
①T1____T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1____(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是______(填字母)。
a. 降低温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
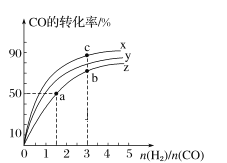
(2)在容积为1 L的恒容容器中,分别研究在300 ℃、350 ℃和370 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线x对应的温度是______℃;曲线z对应的温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com