
【题目】A、B、C是中学化学常见物质(纯净物或水溶液),其转化关系如下(部分反应物或产物未标出;反应条件未标出)。回答下列问题:
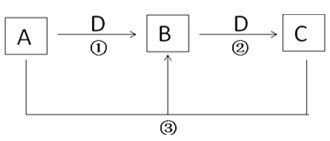
(1)若D为气体,在标况下的密度为1.964g·L-1;A为强碱溶液,其焰色反应为黄色,则反应②的化学方程式为_________________.
(2)若B为白色胶状沉淀,D为强碱溶液.则反应③的离子方程式为___________
(3)若A为黄绿色的气体,D为目前使用量最大的金属单质,则检验B物质中的阳离子时发生的离子方程式为_______________.
(4)若A为一种金属单质,常温下D浓溶液不能溶解A,D稀溶液能溶解A,但不产生H2.则反应②的离子方程式为_______________________.
(5)若D为O2,要实现上面的转化,A、C分别可以是________________(各填一种,填化学式) .
【答案】Na2CO3+CO2+H2O=2NaHCO3 3AlO2—+Al3++6H2O=4Al(OH)3↓ Fe3++3SCN—=Fe(SCN)3 3Fe2++4H++NO3—=3Fe3++NO↑+2H2O C、 CO2 或NH3、NO或H2S、SO2
【解析】
(1)若D为气体,在标况下的密度为1.964g·L-1,D是摩尔质量是1.964g·L-1×22.4L/mol=44g/mol,所以D是CO2,;A为强碱溶液,其焰色反应为黄色,A是NaOH,根据转化关系,B是Na2CO3、C是NaHCO3,则反应②的化学方程式为Na2CO3+CO2+H2O=2NaHCO3;
(2)若B为白色胶状沉淀,D为强碱溶液,根据转化关系,A是铝盐、B是氢氧化铝、C是偏铝酸盐;反应③是铝盐和偏铝酸盐发生双水解反应生成氢氧化铝,离子方程式为3AlO2—+Al3++6H2O=4Al(OH)3↓;
(3)A为黄绿色的气体,A是氯气, D为目前使用量最大的金属单质,D是铁;则B是氯化铁,用KSCN溶液检验Fe3+,发生的离子方程式为Fe3++3SCN—=Fe(SCN)3;
(4)若A为一种金属单质,常温下D浓溶液不能溶解A,D稀溶液能溶解A,但不产生H2,则A是铁、D是硝酸、B是硝酸亚铁、C是硝酸铁,则反应②是Fe2+被硝酸氧化为Fe3+,离子方程式为3Fe2++4H++NO3—=3Fe3++NO↑+2H2O;
(5)若D为O2,要实现上面的转化,A、C分别可以是C、 CO2 或NH3、NO或H2S、SO2。


科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示的装置及药品进行酸性强弱比较的实验。下列说法正确的是

A.①和②中发生的反应均为置换反应
B.其他条件不变,可用盐酸替代稀硫酸
C.一段时间后,②中有胶冻状物质生成
D.该实验证明酸性:硫酸>硅酸>碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论正确的是
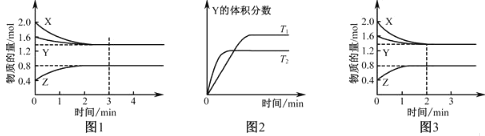
A.反应进行的前3min内,用X表示的反应速率υ(X)=0.3 mol·L-1·min-1
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是

A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可测定中和热。下列关于该实验的说法正确的是
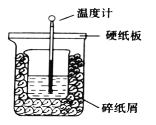
A.从实验装置看(量筒未画出),图中还缺少一个重要的仪器
B.做完一次完整的中和热测定实验,温度计需要使用2次
C.烧杯间的碎纸屑的作用是固定烧杯的位置
D.由于实验过程中有热量的散失,所以测得的中和热△H比理论值要小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是

A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种元素组成的矿物A,测定A的组成流程如下:

请回答:
(1)②反应中除了产生D外,还有一种气体生成,请写出该气体的电子式____________
(2)写出①的化学方程式:_______________________________________________________
(3)写出③的离子方程式:____________________________________________________
(4)检验E溶液中含有Fe2+ 的方法是:_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟氨催化氧化法制硝酸的装置如图所示。下列说法错误的是
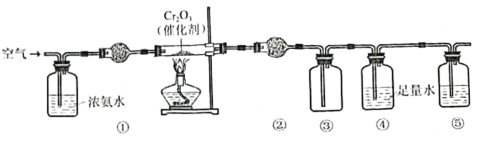
A.装置①、②、⑤依次盛装碱石灰、P2O5、NaOH溶液
B.装置③中产生红棕色气体
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D.通空气的主要作用是鼓出氨气,空气可用N2代替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com