
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论正确的是
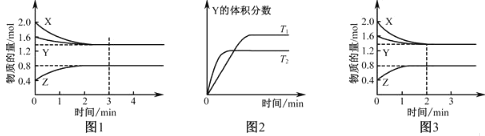
A.反应进行的前3min内,用X表示的反应速率υ(X)=0.3 mol·L-1·min-1
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
【答案】D
【解析】
A. 反应进行的前3min,反应已经达到平衡,平衡时,X的物质的量为1.4mol ,υ(X)= =0.1 mol·L-1·min-1,故A错误;
=0.1 mol·L-1·min-1,故A错误;
B. 由图2知,"先拐平数值大",所以,升高温度Y的体积分数减少,平衡向正反应方向移动,即生成物的浓度增大,反应物的浓度减少,所以平衡常数增大,故B错误;
C. 图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,故C错误;
D. 由图1知,前3min内X的物质的量减少量为2.0mol-1.4mol=0.6mol,Y的物质的量减少量为1.6mol-1.4mol=0.2mol, X、Y为反应物;Z的物质的量增加量为0.8mol-0.4mol=0.4mol, Z为生成物,同一化学反应同一时间段内,反应物减少的物质的量和生成物增加的物质的量之比等于化学计量数之比,所以X、Y、Z的计量数之比=3:1:2,所以反应可表示为3X(g)+Y(g)2Z(g),故D正确;答案选D。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
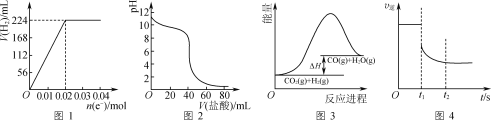
A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法不能达到实验目的的是
A.加热除去食盐中少量的NH4Cl固体
B.用饱和NaHCO3溶液除去CO2中的SO2
C.用稀盐酸除去铜粉中少量的铁粉
D.用BaCl2溶液除去NaCl溶液中的K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为同学们使用的一种碳素墨水笔,在组成这种墨水笔的各种材料中:
![]()
(1)属于有机高分子材料的是(选填一种即可)________。
(2)属于金属材料的是(填元素符号)________,______。
(3)目前世界上对废金属材料已得到回收利用,这样做的意义是______。
(4)碳素墨水是________(填“混合物”或“纯净物”)。
(5)写出其中的金属材料与硫酸铜溶液反应的一个化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,H2(g)与I2(g)反应生成HI(g),反应的能量变化如下图所示。下列说法不正确的是
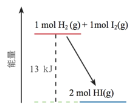
A.H2(g)+I2(g)=2HI(g) ΔH=-13kJ·mol1
B.反应物的总能量比生成物的总能量高
C.H2(g)和I2(g)的总能量比HI(g)的能量高13kJ
D.断裂反应物中化学键吸收的总能量比形成生成物中化学键放出的总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学常见物质(纯净物或水溶液),其转化关系如下(部分反应物或产物未标出;反应条件未标出)。回答下列问题:
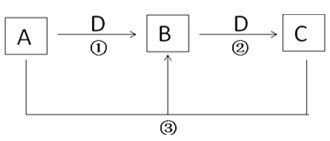
(1)若D为气体,在标况下的密度为1.964g·L-1;A为强碱溶液,其焰色反应为黄色,则反应②的化学方程式为_________________.
(2)若B为白色胶状沉淀,D为强碱溶液.则反应③的离子方程式为___________
(3)若A为黄绿色的气体,D为目前使用量最大的金属单质,则检验B物质中的阳离子时发生的离子方程式为_______________.
(4)若A为一种金属单质,常温下D浓溶液不能溶解A,D稀溶液能溶解A,但不产生H2.则反应②的离子方程式为_______________________.
(5)若D为O2,要实现上面的转化,A、C分别可以是________________(各填一种,填化学式) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(g);△H = —483.6kJ·mol-1,则氢气的燃烧热为241.8kJ
B.已知4P(红磷,s)=P4(白磷,s); △H >0,则白磷比红磷稳定
C.含2.0g NaOH的稀溶液与稀硫酸完全中和,放出2.87kJ的热量,则表示该反应中和热的热化学方程式为: NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(1); △H = —57.4kJ·mol-1
D.已知C(s)+O2(g)=CO2(g); △H1 C(s)+1/2O2(g)=CO(g); △H2 则△H1>△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com