
【题目】下列除杂方法不能达到实验目的的是
A.加热除去食盐中少量的NH4Cl固体
B.用饱和NaHCO3溶液除去CO2中的SO2
C.用稀盐酸除去铜粉中少量的铁粉
D.用BaCl2溶液除去NaCl溶液中的K2SO4
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,观察到灵敏电流计指针偏转,图中a、b电极均为铜单质,下列说法正确的是( )
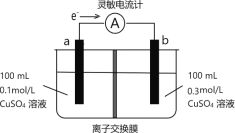
A.该装置的能量转换形式为:电能→化学能
B.b的电极反应为:Cu-2e-=Cu2+
C.溶液中SO![]() 穿过阴离子交换膜发生迁移
穿过阴离子交换膜发生迁移
D.外电路转移的电子最多为0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
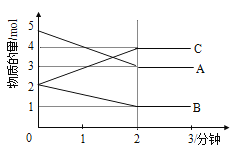
(1)该反应的的化学方程式为_____________________________。
(2)反应开始至2分钟时,B的平均反应速率为_________。
(3)能说明该反应已达到平衡状态的是___________。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(4)由图求得平衡时A的转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示的装置及药品进行酸性强弱比较的实验。下列说法正确的是

A.①和②中发生的反应均为置换反应
B.其他条件不变,可用盐酸替代稀硫酸
C.一段时间后,②中有胶冻状物质生成
D.该实验证明酸性:硫酸>硅酸>碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积可变的密闭容器中发生可逆反应:2NO2(g)![]() 2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
A.单位时间内生成n mol O2的同时生成n mol NO2
B.NO2、NO、O2三者的物质的量浓度之比为2:2:1
C.混合气体的密度不再改变
D.容器中气体压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaS在环境保护、制备电致发光材料等方面用途非常广泛。回答下列问题:
(1)制取CaS的反应如下:
反应(I):CaSO4(s)+2C(s)![]() CaS(s)+2CO2(g) △H1
CaS(s)+2CO2(g) △H1
反应(II):CaCO3(s)+H2S(g)![]() CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
①若在恒温恒容密闭容器中只发生反应(I),达到平衡时向容器中通入少量CO2,则反应再次达到平衡时c(CO2)将___(填“增大”“减小”或“不变”)。
②已知下列热化学方程式:.
i:S2(g)+CaSO4(s)![]() CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
ii:2SO2(g)+4CO(g)=S2(g)+4CO2(g) △H=+16.0kJ·mol-1
iii:C(s)+CO2(g)=2CO(g) △H=+172.5kJ·mol-1
则反应(I)的△H1=___kJ·mol-1。
③反应(II)的△S___(填“>”“<”或“=”)0。若反应(II)在恒温恒容密闭容器中进行,能说明该反应已达到平衡状态的是___(填字母)。
A.v(H2O)正=v(CO2)正
B.容器中气体总压强不再随时间变化
C.容器中同时存在H2S(g)、CO2(g)和H2O(g)
D.单位时间内断裂H-S键与断裂C=O键数目相等
(2)CaS能被许多物质氧化,有关反应的lgKp与温度关系如图(Kp为以分压表示的平衡常数;分压=总压×物质的量分数;图中数据由压强单位为kPa得出)。
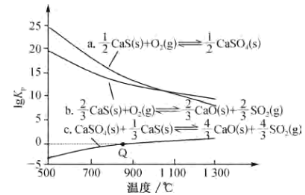
①属于吸热反应的是___ (填“a”“b”或“c”)。
②相同温度下,反应a、b、c的lgKp(a)、lgKp(b)、lgKp(c)之间满足的关系是lgKp(c)=___。
③反应c在Q点时:p(SO2)=___kPa,以浓度表示的平衡常数Kc=___Kp[用R、T表示;已知气体的压强、体积、温度满足pV=nRT(n为气体的物质的量,R为恒量)]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确,且能达到实验目的的是
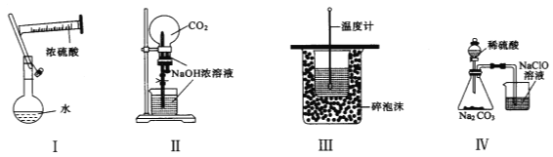
A.实验Ⅰ:配制一定物质的量浓度的稀硫酸
B.实验Ⅱ:用二氧化碳做喷泉实验
C.实验Ⅲ:进行中和热的测定
D.实验Ⅳ:验证酸性强弱H2SO4>H2CO3>HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论正确的是
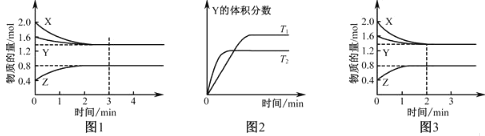
A.反应进行的前3min内,用X表示的反应速率υ(X)=0.3 mol·L-1·min-1
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是

A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com