
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )。
A.K越大,反应物的转化率越小
B.K与反应物的浓度有关
C.K与生成物的浓度有关
D.K与温度有关
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高二人教化学选修五2-1-2脂肪烃炔烃脂肪烃来源及应用练习卷(解析版) 题型:选择题
下列有关乙炔的叙述中,既不同于乙烯又不同于乙烷的是( )
A.能燃烧生成二氧化碳和水
B.能跟溴水发生加成反应
C.能跟酸性KMnO4溶液发生氧化反应
D.能与氯化氢反应生成氯乙烯
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题8电化学原理练习卷(解析版) 题型:填空题
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为___________________________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是____________(填序号)。

a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O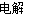 CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式),电极反应式为____________________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:选择题
在下列各组的比较中,前者比后者大的是 ( )。
A.25 ℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
B.25 ℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
C.同温度、同浓度的NaCl溶液和氨水的导电能力
D.25 ℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是 ( )。
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是 ( )。
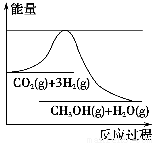
A.降低温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题5化学反应与能量变化练习卷(解析版) 题型:选择题
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是 ( )。
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1
C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1
D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题4物质结构与元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是_________________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题3常见的两种重要反应类型练习卷(解析版) 题型:选择题
向含有下列各组离子的溶液中通入相应气体后,能大量共存的是( )。
A.通入NO2:Na+、Fe2+、Cl-、SO42-
B.通入NH3:AlO2-、NH4+、Na+、NO3-
C.通入Cl2:K+、NH4+、I-、Cl-
D.通入CO2:Na+、K+、NO3-、SiO3-
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(解析版) 题型:选择题
下图所示的实验方法、装置或操作中正确的是 ( )。
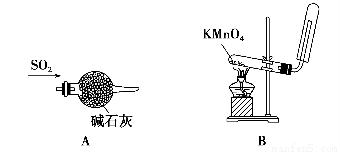
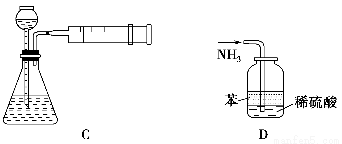
A.干燥SO2 B.实验室制取并收集O2
C.装置气密性的检查 D.吸收氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com