
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
科目:高中化学 来源: 题型:
下表中对离子方程式书写的评价正确的是
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 将铝粉加入含氢氧化钠溶液中: 2Na++2OH-+2Al+H2O=2Na++AlO2-+3H2↑ | 正确 |
| B | Na2O2与H2O反应: Na2O2+H2O===2Na++2OH-+O2↑ | 错误,氧元素不守恒 |
| C | 碳酸氢钠与醋酸反应: HCO3-+H+= H2O+CO2↑ | 正确 |
| D | 向FeCl3溶液中滴加足量氨水: Fe3++3OH-=== Fe(OH)3↓ | 正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
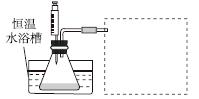
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2溶液、0.1 mol·L-1Fe2(SO4)3溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:______________________________。
②设计实验方案:在不同H2O2浓度下,测定________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成图中的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
(2)利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的__________(填“深”或“浅”),其原因是____________________________。
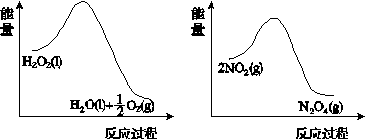
(a) (b)
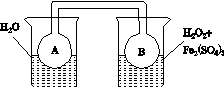
(c)
图21
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:( )
2CH3OH(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器 编号 | 温度(℃) | |||
| 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
.CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=—67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=—57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:
HF(aq)=H+(aq) +F−(aq) △H=+10.4KJ·mol—1
B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D.当V >0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OH B(OCH3)3 +3H2O中,H3BO 3的转化率(
B(OCH3)3 +3H2O中,H3BO 3的转化率(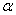 )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:

①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可
[B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可 忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用的几种气体发生装置如图A、B、C所示:


(1)实验室可以用B或C装置制取氨气,如果用B装置,通常使用的药品是________;如果用C装置,通常使用的药品是________;
检查B装置气密性的操作方法是_____________________________________________。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。

(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________
①CO2 ②NO ③Cl2 ④H2
写出A装置中反应的离子方程式____________________________________
其中在D装置中连接小烧杯中应盛放________,目的是_________________________________。
若要收集干燥纯净的X气体,上述装置应如何改进________________________________ ____________________________________ ___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com