
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=—67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=—57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:
HF(aq)=H+(aq) +F−(aq) △H=+10.4KJ·mol—1
B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D.当V >0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
科目:高中化学 来源: 题型:
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。(装置D中的酒精喷灯用来提供高温)
回答下列问题:
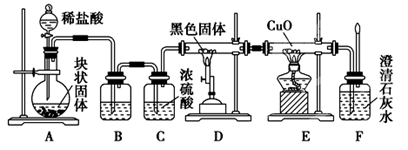
(1) 写出装置A中发生反应的离子方程式 。
(2) 装置B中最适宜的试剂是 。(单选)
A、饱和NaOH溶液 B、Ca(OH)2溶液
C、饱和Na2CO3溶液 D、饱和NaHCO3溶液
(3) 装置D中放置的黑色固体为 (填该固体的名称),发生反应的化学方程式
为 。(同时用单线桥法标明电子转移情况)
(4) 按照如图装置进行实验时,首先进行的操作是 。
(5) 根据实验中的 现象,可证明CO具有还原性,有关反应的化学方程式是 。
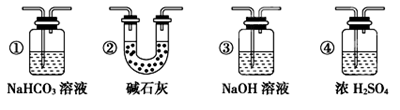
(6) 若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置 与 之间连接下图中的 装置(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为__________________________________________,反应消耗1 mol NaBH4时转移的电子数目为________。
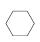 (3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
 (g)
(g)  (g)+3H2(g)。
(g)+3H2(g)。
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。

①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
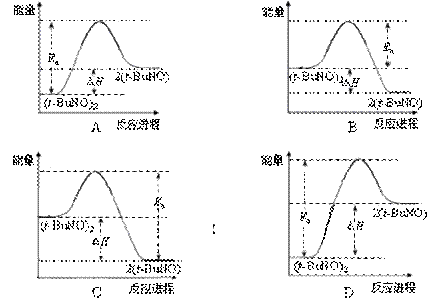
③该储氢装置的电流效率η=____________________。(η=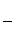 ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ∙mol—1
P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ∙mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。
下列叙述正确的是
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+ PCl3(g)=4PCl5(g)的反应热△H
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ∙mol—1
D.P-P键的键能为(5a-3b+12c)/8 kJ∙mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2  2(t-BuNO) 。
2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K = 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH = 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是 。
(4)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率。用于比色分析的仪器 是 。
A.pH计 B.元素分析仪
C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如下图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线。
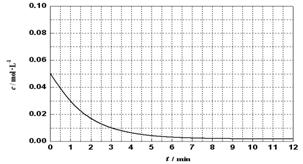
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)  2HI(g)+ 9.48 kJ (ii) I2(S)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(S)+ H2(g) 2HI(g) - 26.48 kJ
2HI(g) - 26.48 kJ
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
下述关于烃的说法中,正确的是( )
A.烃是指仅含有碳和氢两种元素的有机物
B.烃是指分子里含碳元素的化合物
C.烃是指燃烧反应后生成二氧化碳和水的有机物
D.烃是指含有碳和氢元素的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com