
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50s的平均速率v(Cl2)=0.0016 molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 molL﹣1 , 则该反应的△H<0
C.温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2 , 反应达到平衡前v(正)<v(逆)
D.温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2 , 达到平衡时,PCl3的转化率小于80%
【答案】D
【解析】解:A.由表中数据可知50s内,△n(PCl3)=0.16mol,v(PCl3)= ![]() =0.0016mol/(Ls),故A错误;
=0.0016mol/(Ls),故A错误;
B.由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×2L=0.22mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,故B错误;
C.对于反应:
PCl5(g) | PCl3(g)+ | Cl2(g) | |
起始(mol/L) | 0.5 | 0 | 0 |
转化(mol/L) | 0.1 | 0.1 | 0.1 |
平衡(mol/L) | 0.4 | 0.1 | 0.1 |
所以平衡常数k= ![]() =0.025.
=0.025.
起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc= ![]() =0.02,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C错误;
=0.02,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C错误;
D.温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,相当于在加入0.5molPCl5.减小压强,平衡逆向移动,则达到平衡时,达到平衡时,PCl3的物质的量大于0.1mol,则转化的小于0.4mol,PCl3的转化率小于80%,故D正确.
故选D.
A.由表中数据可知50s内,△n(PCl3)=0.16mol,根据v= ![]() 计算v(PCl3);
计算v(PCl3);
B.由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol,根据平衡时n(PCl3),判断平衡移动方向,升高温度平衡向吸热反应方向移动;
C.先求平衡常数K,再求浓度商(Qc),K>Qc,说明平衡向正反应方向移动,K<Qc,说明平衡向逆反应方向移动,K=Qc,说明平衡不移动,据此判断平衡移动;
D.等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,据此判断.


科目:高中化学 来源: 题型:
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
A.92.3%
B.87.6%
C.75%
D.84%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述中,正确的是( ) 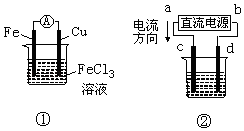
A.装置①是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+
B.装置①中,铁做负极,该电极反应式为:Fe3++e﹣═Fe2+
C.装置②为铁上镀铜装置c为纯铜电极
D.若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作可以达到实验目的的是( )
A.用10mL量筒量取5.60mL浓硫酸
B.用托盘天平称量5.85g NaCl
C.将容量瓶放在烘箱中烘干
D.在烧杯中溶解固体药品时用玻璃棒搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是( )
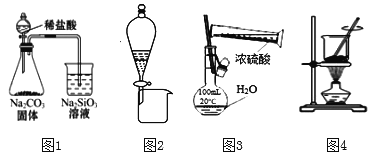
A. 用图1装置证明非金属性Cl>C>Si
B. 利用图2装置,用饱和碳酸钠溶液分离乙醇和乙酸乙酯混合液
C. 图3为配制100 mL一定浓度硫酸溶液
D. 用图4装置灼烧海带
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)肼(N2H4)与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的密度为1.92g/L,且其中氮元素的质量分数为0.977,则该反应的化学方程式为____.
(2)二氧化氮在一定条件下,可以发生如下反应:SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H= -42kJ·mol-1,在2L的恒容密闭容器中充入SO2(g)和NO2(g)所得实验数据如下:
SO3(g)+NO(g) △H= -42kJ·mol-1,在2L的恒容密闭容器中充入SO2(g)和NO2(g)所得实验数据如下:
实验编号 | 温度 | 起始物质的量mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 4.0 | 1.0 | 0.9 |
乙 | T2 | 1.0 | 4.0 | 0.8 |
丙 | T2 | 0.4 | 0.6 | a |
①在实验甲中,若2min时测得放出的热量是8.4kJ,0~2min时间内,用SO2表示的平均反应速率v(SO2)=_______________,该温度下的平衡常数为_________。(结果保留到小数点后两位)
②由表中数据可推知:T1_______T2(填“>”“<”或“=”)
③实验丙中,达到平衡时NO2的转化率为______________.
(3)工业上可以用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。室温下测得NH4HSO3溶液pH为6,则溶液的![]() ________________________.(已知:H2SO3的Kal =1.5×10-2Ka2 =1.0×10-7)
________________________.(已知:H2SO3的Kal =1.5×10-2Ka2 =1.0×10-7)
(4)使用间接电化学法可以处理煤烟气中的NO,装置如图,已知电解池溶液的pH在4~7之间,写出阴极的电极反应式__________________。
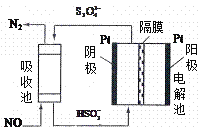 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是_____,其价电子层中有_______个未成对电子。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是_____________。
②其分子中σ键与π键数目之比为_____________________。
③写出一种与配体CO互为等电子体的阴离子符号_____________________。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为_______________,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有________________种。
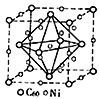
(3)金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为____。
(4)NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为______;若阿伏加德罗常数的值为NA,晶体密度为d g·cm-3,则该晶胞中最近的O2-之间的距离为_______________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
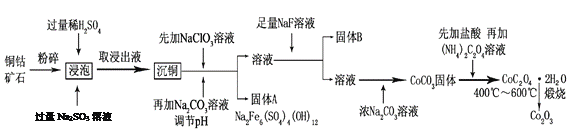
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
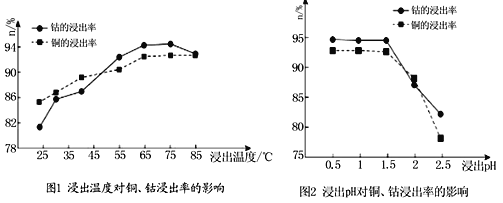
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2 ![]() C6 +LiCoO2
C6 +LiCoO2
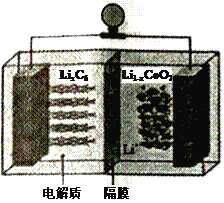
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为 .
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)﹣c(CH3COO﹣)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com