
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.若5.6 L N2中含有n个氮分子,则阿伏加德罗常数一定为4n
B.4.6 g Na与100 mL含0.1 mol HCl的盐酸溶液反应,转移电子数目为0.2NA
C.14 g乙烯和丙烯的混合气体中所含分子总数为0.5NA
D.标准状况下,22.4 L CCl4含有的分子总数为NA
【答案】B
【解析】解:A.5.6 L N2的物质的量不一定为0.25mol,因为气体的体积与温度和压强有关,标准状况是指0℃,1个大气压,只有当气体在标况下,才能使用气体摩尔体积22.4L/mol,5.6 L N2的物质的量n= ![]() =
= ![]() =0.25mol,只有氮气的物质的量为0.25mol时,5.6 L N2中含有n个氮分子,阿伏加德罗常数为4n,该题未指明标况,故A错误;
=0.25mol,只有氮气的物质的量为0.25mol时,5.6 L N2中含有n个氮分子,阿伏加德罗常数为4n,该题未指明标况,故A错误;
B.4.6 g Na的物质的量为n= ![]() =
= ![]() =0.2mol,100 mL含0.1 mol HCl的物质的量为0.01mol,根据2Na+2HCl=2NaCl+H2↑,钠过量,过量的钠与水反应,2Na+2H2O═2NaOH+H2↑,所以0.2mol钠能生成0.1mol的氢气,钠从0价变为上述两反应产物中的+1价钠,失去电子为0.2mol,转移电子数目为0.2NA , 故B正确;
=0.2mol,100 mL含0.1 mol HCl的物质的量为0.01mol,根据2Na+2HCl=2NaCl+H2↑,钠过量,过量的钠与水反应,2Na+2H2O═2NaOH+H2↑,所以0.2mol钠能生成0.1mol的氢气,钠从0价变为上述两反应产物中的+1价钠,失去电子为0.2mol,转移电子数目为0.2NA , 故B正确;
C.乙烯结构简式为CH2=CH2 , 分子式为C2H4 , 丙烯结构简式为CH3﹣CH=CH2 , 分子式为C3H6 , 都可以化成简式(CH2)n也就是说,无论多少克的和乙烯和多少克的丙烯怎么混和,C原子与H原子的数量比永远是1:2,无法求分子总数,故C错误;
D.常温下,四氯化碳为液态,22.4 L CCl4的物质的量不为1 mol,含有的分子总数不为NA , 故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】某学生用优质大理石与稀盐酸反应制取CO2 , 实验结果如图所示,对于图中曲线的叙述正确的是( ) 
A.AB段表示反应速率最慢
B.BC段表示反应速率最快,在该时间内收集到的气体最多
C.OC段表示随时间增加,反应速率逐渐增大
D.OC段表示反应产物中气体体积随时间的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(s)+Y(g) ![]() 2Z(g) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是
2Z(g) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是
A. 在第10 min时,Z的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 增加X的物质的量可以加快反应速率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图.下列说法正确的是( ) 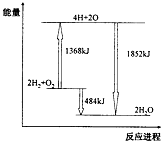
A.拆开2molH2(g)和1 molO2 (g)中的化学键成为H、O原子,共放出1368 kJ能量
B.由H、O原子形成2 molH2O(g),共吸收1852 kJ能量
C.2 molH2(g)和1 molO2(g)反应生成2 molH2O(l),共吸收484 kJ能量
D.2 molH2(g)和1 molO2 (g)反应生成2 moIH2O(g),共放出484 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,下列说法正确的是( )
A. 一定有CH4 B. 一定有CH4、C2H4
C. 可能C2H6 D. 一定有C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为4NaHSO3=2Na2S2O5+2H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是___________。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是_____。
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z,M,N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是( ) 
A.原子半径:Y>Z>W
B.单质的还原性:X>Y
C.溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两容器都在进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少了2molA,则甲容器内的反应速率比乙容器内的反应速率要
A. 快 B. 慢 C. 相等 D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com