
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为4NaHSO3=2Na2S2O5+2H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是___________。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是_____。
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
【答案】 2SO2 + CO2-3 + H2O = 2HSO3- + CO2 安全瓶,防止倒吸 在制备过程中Na2S2O5分解生成Na2SO3,Na2S2O5被氧化生成Na2SO4 0.16 偏低
【解析】(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为2SO2 +CO32- +H2O=2HSO3- +CO2;(2)由于SO2或CO2与氢氧化钠溶液反应时容易倒吸,所以装置Y的作用是安全瓶,防止倒吸;(3)由于在制备过程中Na2S2O5分解生成Na2SO3,Na2S2O5被氧化生成Na2SO4,所以实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4。(4)①由题设滴定反应的化学方程式知,样品中抗氧化剂的残留量(以SO2计算)与I2的物质的量之比为1∶1,n(SO2)=n(I2)=0.01000mol·L-1×0.025L=0.0025mol,残留量=![]() =0.16g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2=2I2+2H2O,导致与SO2反应的I2减少,因此实验结果偏低。
=0.16g·L-1;②由于实验过程中有部分HI被氧化生成I2,4HI+O2=2I2+2H2O,导致与SO2反应的I2减少,因此实验结果偏低。


科目:高中化学 来源: 题型:
【题目】现拟分离乙酸乙酯、乙酸、乙醇的混合物,图是分离操作流程图. 
上述实验过程中涉及的三次分离操作分别是( )
A.①蒸馏 ②过滤 ③分液
B.①分液 ②蒸馏 ③蒸馏
C.①蒸馏 ②分液 ③分液
D.①分液 ②蒸馏 ③结晶 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A. K+、Mg2+、SO42﹣、OH- B. Fe2+、Cl﹣、H+、NO3﹣
C. Na+、K+、CO32﹣、Cl﹣ D. Fe3+、SCN-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 1mol 氧原子的质量是16g/mol B. 12g镁的物质的量为0.5
C. CO2的摩尔质量为44g/mol D. 氢的摩尔质量为2g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.若5.6 L N2中含有n个氮分子,则阿伏加德罗常数一定为4n
B.4.6 g Na与100 mL含0.1 mol HCl的盐酸溶液反应,转移电子数目为0.2NA
C.14 g乙烯和丙烯的混合气体中所含分子总数为0.5NA
D.标准状况下,22.4 L CCl4含有的分子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。下表中所列出的 a、b物质不符合要求的是
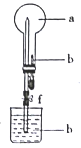
a(干燥气体) | b(液体) | |
A | NO2 | 水 |
B | SO2 | 饱和酸性高锰酸钾溶液 |
C | Cl2 | 饱和NaOH馆液 |
D | NH3 | 2 mol/L.盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg﹣H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( ) 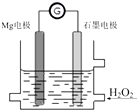
A.石墨电极是该电池的正极
B.石墨电极上发生还原反应
C.Mg电极的电极反应式:Mg﹣2e﹣=Mg2+
D.电池工作时,电子从Mg电极经导线流向石墨电极,再出石墨电极经电解质溶液流向Mg电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加工橘子罐头,采用酸碱处理脱去中果皮(橘络),会产生严重污染。目前使用酶解法去除橘络,可减少污染。下列生长在特定环境中的4类微生物,不能大量产生所用酶的有( )
A. 生长在麦麸上的黑曲霉 B. 生长在酸奶中的乳酸菌
C. 生长在棉籽壳上的平菇 D. 生长在木屑上的木霉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盖斯定律的说法不正确的是
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中△H直接相加即可得总反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com