
【题目】在下列各溶液中,离子一定能大量共存的是( )
A. K+、Mg2+、SO42﹣、OH- B. Fe2+、Cl﹣、H+、NO3﹣
C. Na+、K+、CO32﹣、Cl﹣ D. Fe3+、SCN-、Cl-、K+
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 = Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后NaNO3与FeO·Cr2O3的系数比为__________。该步骤能否_________(填“能”或“不能”)使用陶瓷容器。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_______________及含硅杂质。
(3)步骤④调滤液2的pH使之变_________ (填“大”或“小”),理由是________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到10℃得到的K2Cr2O7固体产品最多。

步骤⑤的化学方程式为 _________________。
(5)某工厂用76Kg铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品41.16Kg, 则产率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g) ![]() 3B(?)+C(?) ΔH>0,达到化学平衡后,改变一个条件,其他条件不变。
3B(?)+C(?) ΔH>0,达到化学平衡后,改变一个条件,其他条件不变。
(1)升高温度:
①若B、C都是气体,气体的平均相对分子质量____(用“变大”、“变小”或“不变”填空,下同);
②若B、C都不是气体,气体的平均相对分子质量____;
③若B是气体,C不是气体,气体的平均相对分子质量____。
(2)增大压强:
①若B是气体,C不是气体,气体的平均相对分子质量____(填“变大”、“变小”或“不变”);
②若B、C均为气体,则气体的平均相对分子质量____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种不同的烃CxHy和CaHb不论以什么比例混合,只要总质量一定,完全燃烧时消耗O2的质量和生成水的质量不变,下列叙述正确的是( )
A. CxHy和CaHb分子中氢原子数一定相等
B. 可能是C2H4和C3H6的混合物
C. CxHy和CaHb一定是同分异构体
D. CxHy和CaHb的最简式可能不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(s)+Y(g) ![]() 2Z(g) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是
2Z(g) △H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是
A. 在第10 min时,Z的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 增加X的物质的量可以加快反应速率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是( )
A. 分离、提纯→确定化学式→确定实验式→确定结构式
B. 分离、提纯→确定实验式→确定化学式→确定结构式
C. 分离、提纯→确定结构式→确定实验式→确定化学式
D. 确定化学式→确定实验式→确定结构式→分离、提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图.下列说法正确的是( ) 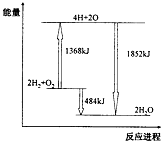
A.拆开2molH2(g)和1 molO2 (g)中的化学键成为H、O原子,共放出1368 kJ能量
B.由H、O原子形成2 molH2O(g),共吸收1852 kJ能量
C.2 molH2(g)和1 molO2(g)反应生成2 molH2O(l),共吸收484 kJ能量
D.2 molH2(g)和1 molO2 (g)反应生成2 moIH2O(g),共放出484 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为4NaHSO3=2Na2S2O5+2H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是___________。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是_____。
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在带有活塞的密闭容器中发生反应:Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g),采用下列措施不能改变反应速率的是
A. 加热 B. 保持容器体积不变,增加通入H2的量
C. 充入N2,保持容器内压强不变 D. 充入N2,保持容器内体积不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com