
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 = Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后NaNO3与FeO·Cr2O3的系数比为__________。该步骤能否_________(填“能”或“不能”)使用陶瓷容器。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_______________及含硅杂质。
(3)步骤④调滤液2的pH使之变_________ (填“大”或“小”),理由是________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到10℃得到的K2Cr2O7固体产品最多。

步骤⑤的化学方程式为 _________________。
(5)某工厂用76Kg铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品41.16Kg, 则产率为_________________。
【答案】 7:2 不能 铁 Al(OH)3 小 2CrO42- + 2H+![]() Cr2O72- + H2O Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl 70%
Cr2O72- + H2O Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl 70%
【解析】(1)铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质,制备重铬酸钾,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,由电子、原子守恒可知,步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2,则FeO·Cr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳;(2)滤渣1含Fe2O3,滤渣1中含量最多的金属元素是Fe,滤渣2的主要成分是Al(OH)3 及含硅杂质;(3)④中调节pH发生2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2+7NaNO2,则FeO·Cr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳;(2)滤渣1含Fe2O3,滤渣1中含量最多的金属元素是Fe,滤渣2的主要成分是Al(OH)3 及含硅杂质;(3)④中调节pH发生2CrO42-+2H+![]() Cr2O72-+H2O,则步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72-;(4)向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体,由溶解度可知,冷却到10℃K2Cr2O7固体的溶解度在四种物质中最小、过滤分离产品最多,10℃时最合适;步骤⑤发生复分解反应Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;(5)用76kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品41.16kg,产率为=实际产量/理论产量,由Cr原子守恒可知,则产率为
Cr2O72-+H2O,则步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72-;(4)向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体,由溶解度可知,冷却到10℃K2Cr2O7固体的溶解度在四种物质中最小、过滤分离产品最多,10℃时最合适;步骤⑤发生复分解反应Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl;(5)用76kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品41.16kg,产率为=实际产量/理论产量,由Cr原子守恒可知,则产率为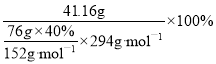 =70%
=70%


科目:高中化学 来源: 题型:
【题目】能证明醋酸是弱酸的事实是( )
A.能溶于水
B.常温下,0.1 mol·Lˉ1醋酸溶液中的c(H+)为1.32×10-3mol·Lˉ1
C.能使紫色石蕊试液变红
D.能被弱碱氨水中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 石英砂可用于生产单晶硅
B. 大多数金属在常温下是固体
C. 可用氢氟酸在玻璃器皿上刻蚀标记
D. 飞机机身的复合材料大多是以金属为增强体、纤维为基体的复合材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18g/cm3,其中氯化镁的质量分数为47.5%,100mL该溶液中氯离子的物质的量等于( )
A. 0.59mol B. 0.295mol C. 1.18mol D. 2.36mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如下实验:

已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为黄色物质。
(1)①中的白色沉淀是___________________。
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化____________________________。
(3)②中生成银的离子反应可能为_________________。
(4)实验①的设计目的_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

(1)滤液A中的阳离子为_____________.
(2)样品中Fe元素的质量为___________g
(3)向滤液A中加H2O2,反应的离子方程式为_____________________.
(4)向样品中加足量稀硫酸时共生成H2O_________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现拟分离乙酸乙酯、乙酸、乙醇的混合物,图是分离操作流程图. 
上述实验过程中涉及的三次分离操作分别是( )
A.①蒸馏 ②过滤 ③分液
B.①分液 ②蒸馏 ③蒸馏
C.①蒸馏 ②分液 ③分液
D.①分液 ②蒸馏 ③结晶 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A. K+、Mg2+、SO42﹣、OH- B. Fe2+、Cl﹣、H+、NO3﹣
C. Na+、K+、CO32﹣、Cl﹣ D. Fe3+、SCN-、Cl-、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com