
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:
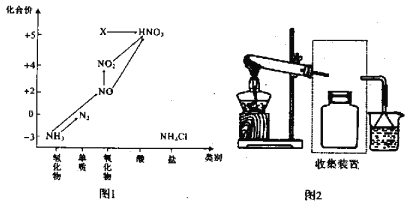
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为____________________。
(2)若要收集一瓶氨气,请将下列装置补充完整,在图2虚框内画出连接图。____________
(3)下列试剂可用于干燥NH3的是________________________________。
A.浓硫酸 B.碱石灰 C.CuSO4固体 D.P2O5
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO化学方程式为________________________________;
②NO→NO2实验现象是________________________________;
③将32.64g铜与l40mL一定浓度的HNO3反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。则其中NO、NO2的物质的量比为____________________。
(5)图1中在标准状况下将NO2、NO、O2混合并充满容器,将该容器倒置于水中,气体完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物质的量浓度M,其数值大小范围为___________
A.0<M<l/22.4 B. 1/39.2<M<1/22.4 C.1/39.2<M<1/28 D.1/28<M<1/22.4
(6)图1中X转化为HNO3的化学方程式为:________________________________。
(7)若要将NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na C.NH4Cl D. NO2
【答案】 Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑ 导气管短进长出 B 4NH3+5O2
CaCl2+2H2O+2NH3↑ 导气管短进长出 B 4NH3+5O2 ![]() 4NO+6H2O 无色变成红色 13 : 12 C N2O5+H2O = 2 HNO3 AD
4NO+6H2O 无色变成红色 13 : 12 C N2O5+H2O = 2 HNO3 AD
【解析】(1)实验室常用NH4Cl与Ca(OH)2制取氨气,生成氯化钙、氨气和水,反应的化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2H2O+2NH3↑;(2)氨气极易溶于水,比空气轻,收集方法只能用向下排空气法收集,导气管位置短进长出,如图
CaCl2+2H2O+2NH3↑;(2)氨气极易溶于水,比空气轻,收集方法只能用向下排空气法收集,导气管位置短进长出,如图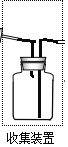 ;(3)A.浓硫酸和氨气反应,不能干燥氨气,选项A错误;B.碱石灰是氢氧化钠和氧化钙固体,可以干燥氨气,选项B正确;C.CuSO4固体吸收水分效果不好,通常用于检验水的存在,选项C错误;D、P2O5和氨气反应,不能干燥氨气,选项D错误;答案选B;(4)①NH3→NO反应是氨气的催化氧化,反应的化学方程式为:4NH3+5O2
;(3)A.浓硫酸和氨气反应,不能干燥氨气,选项A错误;B.碱石灰是氢氧化钠和氧化钙固体,可以干燥氨气,选项B正确;C.CuSO4固体吸收水分效果不好,通常用于检验水的存在,选项C错误;D、P2O5和氨气反应,不能干燥氨气,选项D错误;答案选B;(4)①NH3→NO反应是氨气的催化氧化,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O;②NO→NO2实验现象是无色气体变化为红棕色气体;③n(Cu)=
4NO+6H2O;②NO→NO2实验现象是无色气体变化为红棕色气体;③n(Cu)=![]() =0.51mol,氮氧化物的物质的量=
=0.51mol,氮氧化物的物质的量=![]() =0.5mol,设NO的物质的量是x、二氧化氮的物质为0.5mol-x,根据得失电子守恒知
=0.5mol,设NO的物质的量是x、二氧化氮的物质为0.5mol-x,根据得失电子守恒知![]() ,x=0.26mol,0.5mol-x=0.24mol,NO、NO2的物质的量比为13 : 12;(5)用极差法计算。若该气体由NO2和O2组成,按下式计算:
,x=0.26mol,0.5mol-x=0.24mol,NO、NO2的物质的量比为13 : 12;(5)用极差法计算。若该气体由NO2和O2组成,按下式计算:
4NO2+O2+2H2O====4HNO3
4 4
![]()
![]()
c(HNO3)= ![]() =
=![]() mol·L-1;
mol·L-1;
若该气体由NO和O2组成,则按下式计算:
4NO+3O2+2H2O====4HNO3
4 3 4
![]()
![]()
c(HNO3)=![]() =
=![]() mol·L-1;由于是NO2、NO、O2三者的混合气体,故c(HNO3)的大小范围应是:
mol·L-1;由于是NO2、NO、O2三者的混合气体,故c(HNO3)的大小范围应是:![]() mol·L-1<c(HNO3)<
mol·L-1<c(HNO3)<mol·L-1。答案选C;(6)图1中,+5价的氮的氧化物为N2O5,转化为硝酸的反应方程式为3 N2O5+H2O = 2 HNO3;(7)若要将NH3→N2,氮元素化合价-3价变化为0价,氨气做还原剂被氧化,A.O2可以氧化氨气为氮气,选项A正确;B.Na是还原剂不能氧化氨气,选项B错误;C.NH4Cl中氮元素化合价-3价,不能和氨气反应生成氮气,选项C错误;D.NO2和氨气反应做氧化剂,氮元素化合价可以变化为0价,生成氮气,选项D正确;答案选AD。


科目:高中化学 来源: 题型:
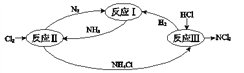
【题目】下图表示氮及其化合物在一定条件下的转化关系:
(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1
2NH3(g) ΔH=–92 kJmol-1
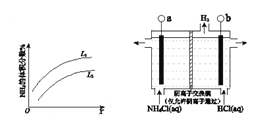
下左图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是________(填“温度”或“压强”)。
(2)①反应II的化学方程式是_________________________。
②反应II其中一步反应为2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462 kJmol-1
已知:N2(g)![]() 2N(g) Cl2(g)
2N(g) Cl2(g)![]() 2Cl(g)
2Cl(g)
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为________kJ。
(3)反应III是利用上图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3 +3H2↑。
NCl3 +3H2↑。
①b接电源的_______极(填“正”或“负”)。② 阳极反应式是___________________。
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在标准状况下,11.2 L NO 与11.2 LO2混合后所含原子数为NA
B. 110 g Na2S2中含有的离子数为3NA
C. 0.1mol·L-1Na2CO3溶液1L所含阴离子数目小于0.1NA
D. 1mol Cl2溶于足量的水中,反应时断裂的Cl-Cl 键数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、n、s是由这些元素组成的二元化合物。p和r分别是元素Z和X的单质,p通常为黄绿色气体。常温下0.01mol·L-1q的水溶液的pH为12。上述物质的转化关系如图所示。下列说法正确的是
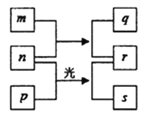
A. 离子半径的大小Z>Y>X B. 单质的还原性:Y>W
C. W在化合物中一定是+1价 D. Z的氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯水能微弱地电离出H+和OH﹣ , 在25℃时,水电离出的H+和OH﹣浓度为 . 水的电离过程是一个吸热过程,升高温度,水的离子积(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S→TiO2/S*(激发态)
TiO2/S*→TiO2/S*+e-
I3-+2e-→3I-
2TiO2/S++3I-→2TiO2/S+I3-
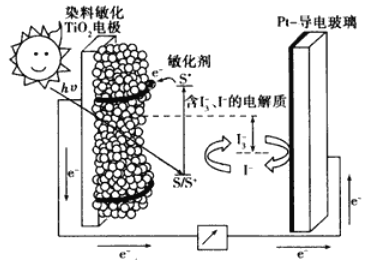
下列关于该电池叙述错误的是
A. 电池工作时,是将太阳能转化为电能
B. 电池工作时,I-离子在镀铂导电玻璃电极上放电
C. 电池中镀铂导电玻璃为正极
D. 电池的电解质溶液中I-和I3-的浓度不会减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在无色玻璃试剂瓶中
B.少量钠保存在煤油中
C.氢氧化钠溶液保存在带有橡皮塞的玻璃试剂瓶中
D.新制氯水通常保存在棕色试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com