
【题目】相对分子质量为70的烯烃的分子式为;若该烯烃与足量的H2加成后能生成含3个甲基的烷烃,则该烯烃的可能的结构简式为 .
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍,工业上用C1O2气体制NaClO2的工艺流程如下:

己知:NaClO2饱和溶液在低于38℃时析出NaC1O2·3H2O,高于38℃时析出NaClO2
下列说法不正确的是
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
C. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:
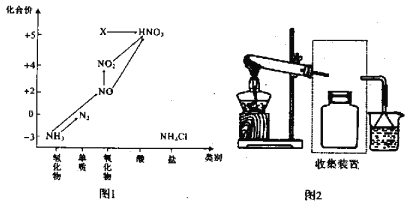
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为____________________。
(2)若要收集一瓶氨气,请将下列装置补充完整,在图2虚框内画出连接图。____________
(3)下列试剂可用于干燥NH3的是________________________________。
A.浓硫酸 B.碱石灰 C.CuSO4固体 D.P2O5
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO化学方程式为________________________________;
②NO→NO2实验现象是________________________________;
③将32.64g铜与l40mL一定浓度的HNO3反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。则其中NO、NO2的物质的量比为____________________。
(5)图1中在标准状况下将NO2、NO、O2混合并充满容器,将该容器倒置于水中,气体完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物质的量浓度M,其数值大小范围为___________
A.0<M<l/22.4 B. 1/39.2<M<1/22.4 C.1/39.2<M<1/28 D.1/28<M<1/22.4
(6)图1中X转化为HNO3的化学方程式为:________________________________。
(7)若要将NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na C.NH4Cl D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液密度为1.1g.cm-3,物质的量浓度为5.0mol·L-1,下列说法不正确的是
A. 25℃时,饱和NaCl溶波的物质的量浓度大于5.0mol/L
B. 20℃时,饱和NaCl溶液的质量分数约为26.6%
C. 20℃时,密度小于1.1g/cm3的NaCl溶液是不饱和溶液
D. 将此饱和NaCl溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.1g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几种元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 失去一个电子后,形成Ne原子电子层结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
Z | 形成双原子单质分子,黄绿色气体 |
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是__________。
(2)画出T的原子结构示意图__________。
(3)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
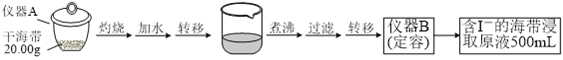
取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
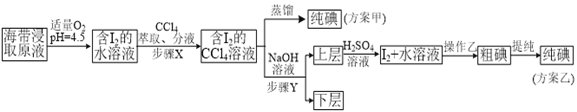
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一) 中的仪器名称:仪器A_________, 仪器 B___________________。
(2)该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为_______%。
(3)①分液漏斗使用前须检漏,检漏方法为___________________。
②步骤X中,萃取后分液漏斗内观察到的现象是_______________。
③下列有关步骤Y的说法,正确的是___________________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是______________________。
(4)方案甲中采用蒸馏不合理,理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
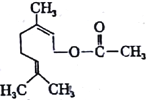
①1mol该有机物可消耗3molH2;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH
A. ②③⑤ B. ①④⑤ C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在常温常压下: ①2CH3OH(l)+2O2(g)═2CO(g)+4H2O(g)△H=﹣a kJmol﹣1
②2CO(g)+O2(g)═2CO2(g)△H=﹣b kJmol﹣1
③H2O(g)═H2O(l)△H=﹣c kJmol﹣1
则表示CH3OH(l)燃烧热的热化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com