
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、n、s是由这些元素组成的二元化合物。p和r分别是元素Z和X的单质,p通常为黄绿色气体。常温下0.01mol·L-1q的水溶液的pH为12。上述物质的转化关系如图所示。下列说法正确的是
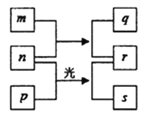
A. 离子半径的大小Z>Y>X B. 单质的还原性:Y>W
C. W在化合物中一定是+1价 D. Z的氧化物的水化物为强酸
【答案】B
【解析】p为黄绿色气体,则p是Cl2;p是元素Z的单质,则Z是Cl元素;常温下0.01mol·L-1q的水溶液pH为12,则q为一元强碱,短周期元素中能形成强碱的金属阳离子只有Na+,故q为NaOH,含有Na、O、H三种元素;W、X、Y的原子序数依次增加,所以W为H元素,X为O元素,Y为Na元素;r是X的单质,所以r为O2。
A、元素X、Y、Z形成的离子分别为:O2-、Na+、Cl-,O2-与Na+核外电子排布相同,均有2个电子层,Cl-有3个电子层。电子层数越大,半径越大,Cl-半径最大;电子层数相同时,核电荷数越大半径越小,所以半径O2->Na+,所以三者离子半径大小顺序为Cl->O2->Na+,即Z>X>Y,故A错误;B、Y的单质为Na,而W的单质为H2,Na能在水中置换出H2,故Na的还原性强于H2,即Y>W,故B正确;C、W(H)常见的价态为+1价,NaH中H为-1价,故C错误;D、元素Z(Cl)的非金属性很强,其最高价氧化物的水化物HClO4为最强酸,但Cl的其他价态的氧化物的水化物酸性不一定强,比如HClO为弱酸,故D错误。选B。


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) ![]() 3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. Q点时,Y的转化率最大
B. W点X的正反应速率等于M点X的正反应速率
C. 升高温度,平衡常数增大
D. 温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
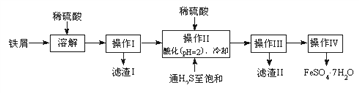
查询资料,得有关物质的数据如下表:
25℃时 | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 |
pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为____________________。
A.KSCN溶液B.NaOH溶液C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是(写两点)___________、____________。
(3)操作IV的顺序依次为________、冷却结晶、过滤。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为_________(填仪器名称)。
②计算上述样品中FeSO47H2O的质量分数为__________。
③上述测定中,若滴定管规格为50mL,则步骤a中称取样品的质量不能超过______g。(保留4位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气阴极祛制备H2O2是一种环境友好型制备方法,装置如图所示,下列说法错误的是
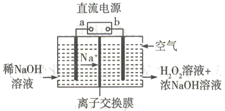
A. b为直流电源的负极
B. 本装置使用的交换膜为阳离子交换膜
C. 通入空气的电极反应式可能为O2+2e-+2H2O=H2O2+2OH-
D. 若生成17g双氧水,则需要通入含11.2 LO2 的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:
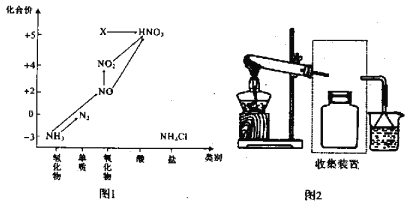
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为____________________。
(2)若要收集一瓶氨气,请将下列装置补充完整,在图2虚框内画出连接图。____________
(3)下列试剂可用于干燥NH3的是________________________________。
A.浓硫酸 B.碱石灰 C.CuSO4固体 D.P2O5
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO化学方程式为________________________________;
②NO→NO2实验现象是________________________________;
③将32.64g铜与l40mL一定浓度的HNO3反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。则其中NO、NO2的物质的量比为____________________。
(5)图1中在标准状况下将NO2、NO、O2混合并充满容器,将该容器倒置于水中,气体完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物质的量浓度M,其数值大小范围为___________
A.0<M<l/22.4 B. 1/39.2<M<1/22.4 C.1/39.2<M<1/28 D.1/28<M<1/22.4
(6)图1中X转化为HNO3的化学方程式为:________________________________。
(7)若要将NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na C.NH4Cl D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中使用数轴的表示方法可起到直观、形象的效果,下列表达中不正确的是( )
A. 常温下溶液的pH与酸碱性的关系: ![]()
B. Fe在Cl2中的燃烧产物: 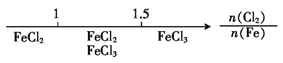
C. 硫的化合物中化合价与其氧化性、还原性的关系: 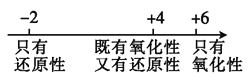
D. 氨水与SO2反应后溶液中的铵盐: 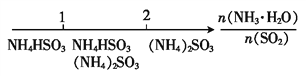
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为中学化学中的常见物质,其中C和D为气体单质,F是一种有磁性的黑色固体。它们存在如下转化关系,反应中生成的水及次要产物均已略去。

(1)写出有关物质的化学式:A______________,H______________。
(2)指出MnO2在相关反应中的作用:反应①中是___________剂,反应②中是________剂。
(3)写出B与MnO2共热获得D的化学方程式:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com