
【题目】下列物质中不能使酸性KMnO4溶液褪色的是( )
①乙烯 ②苯 ③乙醇 ④甲烷 ⑤乙酸 ⑥二氧化硫
A.①②③④⑤B.②④⑤C.②④⑤⑥D.①③⑥
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A. 常温常压下,64g SO2中含有的原子数为3NA
B. 标准状况下,11.2L CCl4所含原子数目为2.5NA
C. 2L 0.1 molL﹣1K2SO4溶液中含K+物质的量为0.2 mol
D. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,HCOOH(甲酸)比NH3H2O电离常数大。向10 mL 0.1mol/L HCOOH中滴加同浓度的氨水,有关叙述正确的是( )
A. 滴加过程中水的电离程度始终增大
B. 当加入10 mL NH3H2O时,c(NH4+) > c(HCOO-)
C. 当两者恰好中和时,溶液pH = 7
D. 滴加过程中n(HCOOH)与n(HCOO-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O②气体液化的温度:NO2 21℃、 NO –152℃

(1)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是__________。
(2)该实验装置明显缺陷是 ________________________________________________。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是____________________________。
②装置B的作用是_______________________________________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)①水合肼(N2H4·H2O)是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素[CO(NH2)2]反应制得粗肼(N2H4)。生成粗肼反应的化学方程式为_______________。
②火箭发射时可用肼(N2H4)为燃料,二氧化氮作氧化剂,生成无毒害的物质,写出反应方程式 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入 1mol N2, 右边充入 CO 和 CO2 的混合气体共 8g 时,隔板处于如图位置(保持温度不变),下列说法正确的是
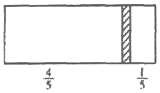
A. 右边 CO 与 CO2 分子数之比为 1:3
B. 右侧 CO 的质量为 2.75g
C. 若改变右边 CO 和 CO2 的充入量而使隔板处于离右端1/6处, 保持温度不变,则前后两次充入容器内的气体压强之比为 5: 3
D. 右侧气体密度是相同条件下氢气密度的 16 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。已知:AlN+NaOH+H2O═NaAlO2+NH3↑
(方案 1)取一定量mg 的样品,用图1装置测定样品中AlN的纯度(夹持装置已略去)。
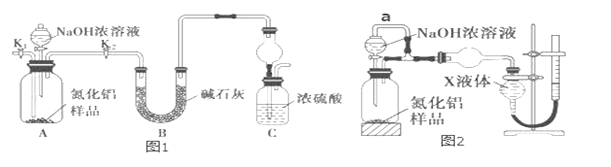
(1)如图 1,C 装置中球形干燥管的作用是_____。
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。接下来的实验操作是______________ ,打开分液漏斗活塞,加入 NaOH 浓溶液,至不再产生气体。打开 K1,通入氮气一段时间,测定 C 装置反应前后的质量变化。通入氮气的目的是___________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_____。
(方案 2)用图 2 装置测定 mg 样品中 AlN 的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是_____。(填字母序号)
a.CCl4 b.H2O c.NH4Cl 溶液 d.C6H6(苯)
(5)若 mg 样品完全反应,测得生成气体的体积为 VmL(已转换为标准状况),则 AlN 的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体物质X中可能含有Fe、Fe2O3、CuO、KCl和Na2CO3中的若干种,为确定其组成,取物质X做如下实验。下列说法正确的是:

A. 固体N可能是Fe、Cu的混合物
B. 溶液Z一定含有KCl和Na2CO3
C. 物质X中一定含有Fe、CuO、Na2CO3
D. 向溶液M中加入KSCN溶液,若溶液不变红,说明物质X中不含Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mLFeCl3溶液中使铜全部溶解(电路板上其他物质均不发生反应),测得电路板质量减少了3.2 g,在浸泡液中加足量的Fe粉并使之充分反应,过滤干燥固体,固体质量比加入的Fe粉质量减少了2.4g。
请计算:
(1)浸泡液中的溶质是__________(写化学式) 。
(2)参与反应的铁的质量是__________g。
(3)假设溶液的体积不变,最后所得溶液中c(Fe2+)=__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现如今太阳能电池已经广泛地应用于生产生活中,现代四大发明之一的共享单车也用上了太阳能电池。哈罗单车前面载物篮的底座就是太阳能电池,电极材料是Li/LiCoO2,太阳能电池的原理如图所示:下列说法不正确的是 ( )
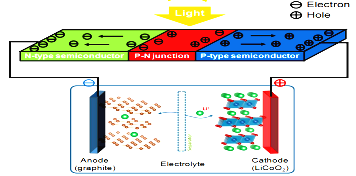
A. 阳光照射该电池时,能量转化过程:太阳能→电能→化学能
B. 光照时负极的质量减少
C. 太阳能电池板材料是Si
D. 开锁时,正极xLi++xe-+Li(1-x)CoO2=LiCoO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com