
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。已知:AlN+NaOH+H2O═NaAlO2+NH3↑
(方案 1)取一定量mg 的样品,用图1装置测定样品中AlN的纯度(夹持装置已略去)。
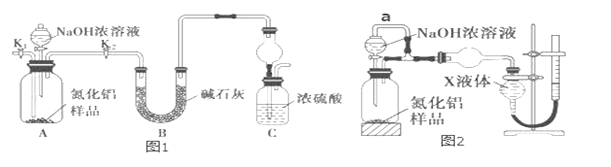
(1)如图 1,C 装置中球形干燥管的作用是_____。
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。接下来的实验操作是______________ ,打开分液漏斗活塞,加入 NaOH 浓溶液,至不再产生气体。打开 K1,通入氮气一段时间,测定 C 装置反应前后的质量变化。通入氮气的目的是___________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_____。
(方案 2)用图 2 装置测定 mg 样品中 AlN 的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是_____。(填字母序号)
a.CCl4 b.H2O c.NH4Cl 溶液 d.C6H6(苯)
(5)若 mg 样品完全反应,测得生成气体的体积为 VmL(已转换为标准状况),则 AlN 的质量分数是_____________。
【答案】防止倒吸关闭 K1,打开 K2把装置中残留的氨气全部赶入 C 装置C 装置出口处连接一个干燥装置ad![]() ×100%
×100%
【解析】
在图1中,AlN和NaOH溶液反应生成氨气,经碱石灰干燥后被浓硫酸吸收,准确测定C装置增重的质量计算AlN的含量;在图2中,AlN和NaOH溶液反应生成氨气,利用排液体法测定氨气的体积计算AlN的含量。
(1).在装置A中,AlN和NaOH溶液反应生成氨气,氨气与浓硫酸发生反应,易发生倒吸,C装置中球形干燥管的作用是防止倒吸,故答案为:防止倒吸;
(2).组装好实验装置,先检查装置气密性,加入实验药品。接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是把装置中残留的氨气全部赶入装置C被浓硫酸吸收,故答案为:关闭 K1,打开 K2;把装置中残留的氨气全部赶入C装置;
(3).装置存在的缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,改进的措施是在C装置出口处连接一个干燥装置,故答案为:C装置出口处连接一个干燥装置;
(4).a.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故a正确;
b.氨气极易溶于水,不能用排水法测定,故b错误;
c.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故c错误;
d.氨气不溶于苯,可以利用排苯溶液的方法测定氨气的体积,故d正确,答案选:ad;
(5).若mg样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),
AlN+NaOH+H2O═NaAlO2+NH3↑
41 22.4L
m V×103L
m=![]() g,则AlN的质量分数为
g,则AlN的质量分数为![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】Ⅰ、在下列转化关系中,烃A为石油的裂解气里含量较高的气体(碳元素的质量分数为0.857),B分子中含有三元环,分子式为C2H4O;1molD与足量Zn反应生成22.4LH2(标准状况);E为六元环化合物。请回答下列问题:
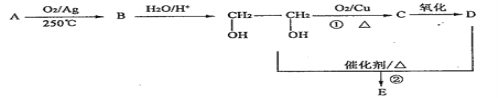
(1)A 的结构简式____________。
(2)①的反应类型为___________。
(3)D中官能团的名称是____________。
(4)写出反应②的化学方程式___________。
Ⅱ、化合物W可用作高分子膨胀剂,一种合成路线如下:
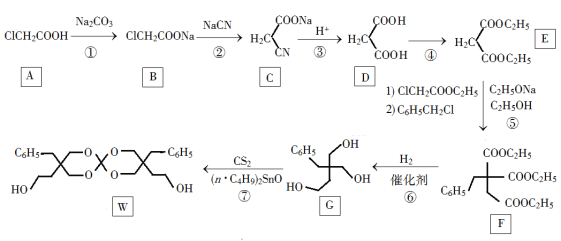
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)G的分子式为________。
(4)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。(写出一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | c | |||||||||||||||
e | f | ||||||||||||||||
试回答下列问题:
(1)写出元素e的基态原子电子排布式________________,其未成对电子数为________。
(2)c在空气中燃烧产物的分子构型为_____,中心原子的杂化形式为______杂化。c能形成一种八元环状形同王冠的单质分子,原子的杂化形式为______杂化。
(3)b单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
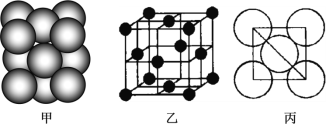
若已知b的原子半径为d厘米,NA代表阿伏加德罗常数,b的相对原子质量为M,请回答:
①晶胞中b原子的配位数为_____,表示原子空间占有率的代数式为_____________。
②该晶体的密度为_____________g/cm3(用含有关字母的代数式表示)。a、f中,与单质b晶体中原子的堆积方式相同的是__________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中不能使酸性KMnO4溶液褪色的是( )
①乙烯 ②苯 ③乙醇 ④甲烷 ⑤乙酸 ⑥二氧化硫
A.①②③④⑤B.②④⑤C.②④⑤⑥D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下浓度均为0.1 mol·Lˉ1的盐酸和醋酸溶液,下列说法正确的是
A. c(CH3COOˉ)=c(Clˉ)
B. 醋酸溶液的pH小于盐酸
C. 醋酸的电离方程式:CH3COOH=CH3COOˉ+H+
D. 等物质的量浓度、等体积的盐酸与氢氧化钠溶液混合后溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。对于C60与棒碳,下列说法正确的是
A.C60与棒碳中所有的化学键都是非极性共价键
B.棒碳不能使溴水褪色
C.C60在一定条件下可能与CuO发生置换反应
D.棒碳与乙炔互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是_____,违反了洪特规则的是______。
![]()
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na________Mg,Mg________Ca。
②电负性:O________F,F________Cl。
③能量高低:ns________(n+1)s,ns________np。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。
已知:①草酸亚铁不溶于水,可溶于酸;②Fe(SCN)63-+3C2O42-=Fe(C2O4)33-+6SCN-。
回答下列问题:
Ⅰ.甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为_______(填“正确”或“不正确”),理由是___________________________________。
Ⅱ.乙同学为测定草酸亚铁晶体FeC2O4﹒xH2O中的结晶水含量,利用如下装置:
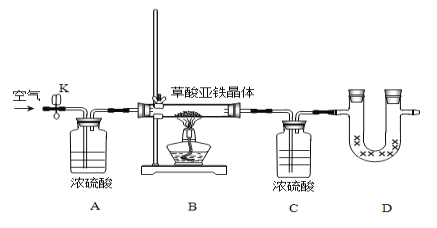
①做实验前首先要_____________________________;
②称取一定质量的晶体,装好药品,开始实验接下来的实验步骤依次为____________________,重复实验直至B中恒重。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入空气 e.冷却至室温 f.称量
Ⅲ.丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取a克草酸亚铁晶体溶入稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用c mol/L的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)
(1)写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式_____________________
(2)上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有__________
(3)x=_______________
(4)若实验中滴入KMnO4溶液过多,则所得x值___________(填偏大、偏小或无影响)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com