
【题目】1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。对于C60与棒碳,下列说法正确的是
A.C60与棒碳中所有的化学键都是非极性共价键
B.棒碳不能使溴水褪色
C.C60在一定条件下可能与CuO发生置换反应
D.棒碳与乙炔互为同系物
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】无色气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,下列说法正确的是( )

A. 甲气体肯定有NO2
B. 经过浓硫酸处理后余气中NO、CO2体积比为2:3
C. 甲气体的组成可能为NH3、NO、NO2
D. 经过Na2O2处理后剩余气体体积大于80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O②气体液化的温度:NO2 21℃、 NO –152℃

(1)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是__________。
(2)该实验装置明显缺陷是 ________________________________________________。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是____________________________。
②装置B的作用是_______________________________________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)①水合肼(N2H4·H2O)是一种重要的化工原料,在医药、农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用NaClO溶液、NaOH溶液与尿素[CO(NH2)2]反应制得粗肼(N2H4)。生成粗肼反应的化学方程式为_______________。
②火箭发射时可用肼(N2H4)为燃料,二氧化氮作氧化剂,生成无毒害的物质,写出反应方程式 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。已知:AlN+NaOH+H2O═NaAlO2+NH3↑
(方案 1)取一定量mg 的样品,用图1装置测定样品中AlN的纯度(夹持装置已略去)。
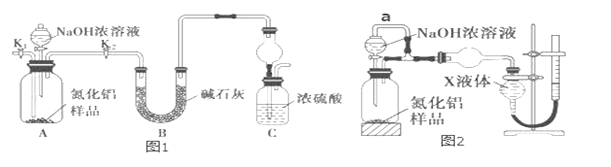
(1)如图 1,C 装置中球形干燥管的作用是_____。
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。接下来的实验操作是______________ ,打开分液漏斗活塞,加入 NaOH 浓溶液,至不再产生气体。打开 K1,通入氮气一段时间,测定 C 装置反应前后的质量变化。通入氮气的目的是___________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_____。
(方案 2)用图 2 装置测定 mg 样品中 AlN 的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是_____。(填字母序号)
a.CCl4 b.H2O c.NH4Cl 溶液 d.C6H6(苯)
(5)若 mg 样品完全反应,测得生成气体的体积为 VmL(已转换为标准状况),则 AlN 的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体物质X中可能含有Fe、Fe2O3、CuO、KCl和Na2CO3中的若干种,为确定其组成,取物质X做如下实验。下列说法正确的是:

A. 固体N可能是Fe、Cu的混合物
B. 溶液Z一定含有KCl和Na2CO3
C. 物质X中一定含有Fe、CuO、Na2CO3
D. 向溶液M中加入KSCN溶液,若溶液不变红,说明物质X中不含Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
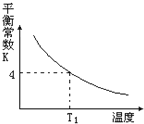
【题目】T2℃时,将1 mol X和2 mol Y投入2L的密闭容器中,发生反应:X(g)+2Y(g)![]() 3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
Y | 2 | 1.60 |
A. 前5 min用Z表示的平均反应速率为1.2mol/(L·min)
B. T2℃时,对于反应1/2X(g)+Y(g)![]() 3/2Z(g) △H’ 2ΔH’=ΔH
3/2Z(g) △H’ 2ΔH’=ΔH
C. T2℃时,若以1mol X、2mol Y和1mol Z充入上述容器中,达到平衡时X的体积分数比φ大
D. 该反应的正反应是吸热反应,且T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mLFeCl3溶液中使铜全部溶解(电路板上其他物质均不发生反应),测得电路板质量减少了3.2 g,在浸泡液中加足量的Fe粉并使之充分反应,过滤干燥固体,固体质量比加入的Fe粉质量减少了2.4g。
请计算:
(1)浸泡液中的溶质是__________(写化学式) 。
(2)参与反应的铁的质量是__________g。
(3)假设溶液的体积不变,最后所得溶液中c(Fe2+)=__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①金属和非金属化合形成离子键
②离子键是阳离子,阴离子的相互吸引
③两个非金属原子间不可能形成离子键
④非金属原子间不可能形成离子键
⑤离子化合物可能含有共价键
⑥共价化合物中可能有离子键
A. ![]() B.
B. ![]() C. ③ ⑤D.
C. ③ ⑤D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com