
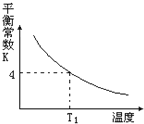
【题目】T2℃时,将1 mol X和2 mol Y投入2L的密闭容器中,发生反应:X(g)+2Y(g)![]() 3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
Y | 2 | 1.60 |
A. 前5 min用Z表示的平均反应速率为1.2mol/(L·min)
B. T2℃时,对于反应1/2X(g)+Y(g)![]() 3/2Z(g) △H’ 2ΔH’=ΔH
3/2Z(g) △H’ 2ΔH’=ΔH
C. T2℃时,若以1mol X、2mol Y和1mol Z充入上述容器中,达到平衡时X的体积分数比φ大
D. 该反应的正反应是吸热反应,且T1<T2
【答案】B
【解析】
前5分钟消耗X的物质的量为0.5mol,由方程式可知Z的物质的量,从而计算反应速率。反应热和计量数呈正比关系,由图可知,随着温度升高,平衡常数减小,说明升温平衡向逆向进行移动,由表中数据计算平衡常数,再进行比较温度高低。
A.前5分钟消耗X的物质的量为0.5mol,由方程式可知生成Z1.5mol,则用Z表示反应速率为![]() =0.15 mol/(L·min),故错误;B.反应热与计量数呈正比,则T2℃时,对于反应1/2X(g)+Y(g)
=0.15 mol/(L·min),故错误;B.反应热与计量数呈正比,则T2℃时,对于反应1/2X(g)+Y(g)![]() 3/2Z(g) △H’ 则2ΔH’=ΔH,故正确;C.反应前后体积不变,增大若以1mol X、2mol Y和1mol Z充入上述容器中,等效于加入4/3molX和8/3molY,体积比为1:2,与原平衡等效,X的转化率不变,故错误;D.由图可知,随着温度升高,平衡常数减小,说明升温平衡向逆向移动,则正反应为放热反应,由表中数据可知,5分钟达到平衡,平衡时X为0.5mol则
3/2Z(g) △H’ 则2ΔH’=ΔH,故正确;C.反应前后体积不变,增大若以1mol X、2mol Y和1mol Z充入上述容器中,等效于加入4/3molX和8/3molY,体积比为1:2,与原平衡等效,X的转化率不变,故错误;D.由图可知,随着温度升高,平衡常数减小,说明升温平衡向逆向移动,则正反应为放热反应,由表中数据可知,5分钟达到平衡,平衡时X为0.5mol则
X(g)+2Y(g)![]() 3Z(g)
3Z(g)
开始1 2 0
改变 0.5 1 1.5
平衡 0.5 1 1.5
由于反应前后气体的体积不变,用物质的量代替浓度计算平衡常数,故有K= ![]() ,大于温度T1时的平衡常数4,故温度T1>T2,故错误。故选B。
,大于温度T1时的平衡常数4,故温度T1>T2,故错误。故选B。


科目:高中化学 来源: 题型:
【题目】如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )

①X、Y的最高价氧化物的水化物酸性为Y<X;②Y、Z的气态氢化物的稳定性Y<Z;③W的单质常温下呈液态,一定条件下可与铁粉反应;④W的原子序数比Z大9。
A. 只有③ B. ①② C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下浓度均为0.1 mol·Lˉ1的盐酸和醋酸溶液,下列说法正确的是
A. c(CH3COOˉ)=c(Clˉ)
B. 醋酸溶液的pH小于盐酸
C. 醋酸的电离方程式:CH3COOH=CH3COOˉ+H+
D. 等物质的量浓度、等体积的盐酸与氢氧化钠溶液混合后溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。对于C60与棒碳,下列说法正确的是
A.C60与棒碳中所有的化学键都是非极性共价键
B.棒碳不能使溴水褪色
C.C60在一定条件下可能与CuO发生置换反应
D.棒碳与乙炔互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组研究混有少量氯化钠杂质的纯碱样品,设计如下装置来测定该纯碱样品的纯度。实验步骤如下:
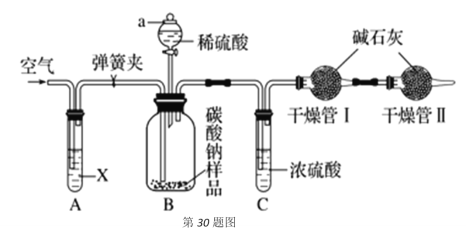
①组装好仪器并检查气密性;
②用托盘天平称量干燥管Ⅰ的质量为m1;
③称量纯碱样品的质量为n,装入广口瓶B内;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤往试管A缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的质量为m2。
请回答:
(1)试剂X是__________,写出广口瓶B中反应的化学方程式__________。
(2)干燥管Ⅱ的作用是__________。
(3)步骤④若滴入稀硫酸过快,会导致测定结果__________(填“偏大”、“偏小”或者“不变”);理由是__________。
(4)根据此实验,计算纯碱样品纯度的为__________(用含m1、m2、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是_____,违反了洪特规则的是______。
![]()
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na________Mg,Mg________Ca。
②电负性:O________F,F________Cl。
③能量高低:ns________(n+1)s,ns________np。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种重要材料的中间体,结构简式为:![]() 。合成M的一种途径如下:
。合成M的一种途径如下:
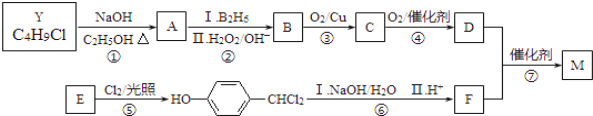
A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去.
已知:①Y的核磁共振氢谱只有1种峰;
②RCH=CH2 ![]() RCH2CH2OH;
RCH2CH2OH;
③两个羟基连接在同一个碳原子上不稳定,易脱水: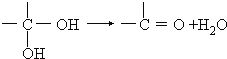
请回答下列问题:
(1)Y的结构简式是________,D的官能团名为________。
(2)步骤①的化学反应方程式是________。
(3)步骤⑤的反应类型是________。
(4)写出步骤⑥中第Ⅰ步化学反应方程式是________。
(5)下列说法不正确的是________。
a.A和E都能发生氧化反应 b.1molB完全燃烧需6mol O2
c.C能与新制氢氧化铜悬浊液反应 d.1molF最多能与3mol H2反应
(6)M经催化氧化得到X(C11H12O4),X的同分异构体中同时满足下列条件的结构简式为________。
a.苯环上只有两个取代基,苯环上的一氯代物有2种
b.水解只生成芳香醇和二元酸,且二元酸的核磁共振氢谱只有2种峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关生活中的醋酸,其中主要利用了醋酸酸性的是( )
①醋酸不小心滴到大理石桌面上,桌面失去光泽 ②熏醋可一定程度上防治流行性感冒 ③醋可以除去水壶中的水垢 ④用醋烹饪鱼,除去鱼的腥味
A.①③
B.②④
C.①④
D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com