
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是_____,违反了洪特规则的是______。
![]()
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na________Mg,Mg________Ca。
②电负性:O________F,F________Cl。
③能量高低:ns________(n+1)s,ns________np。
【答案】 ② ③ 1s22s22p63s23p4 H2SO4 < > < > < <
【解析】(1)泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子;洪特规则:在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同;
(2)同一元素的原子中,基态和激发态原子的核外电子总数相等,根据构造原理书写其基态原子核外电子排布式;在主族元素中,元素的最高化合价等于其族序数,从而确定其最高价氧化物对应的水化物;
(3)根据电负性、电离能的变化规律解答;电子的能层越大其能量越高,同一能层的电子,按s、p、d能量逐渐增大。
(1)泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子,所以违反泡利不相容原理的是②;洪特规则是指在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同,因此违反洪特规则的有③;
(2)根据激发态原子核外电子排布式知该元素核外有16个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p4,该元素是S元素,S元素最外层有6个电子,其最高化合价是+6价,其最高价氧化物对应的水化物是硫酸,其化学式为H2SO4;
(3)①同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素,同一主族元素中,元素的第一电离能随着原子序数的增大而减小,所以第一电离能:Na<Mg,Mg>Ca;
②同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,所以电负性:O<F,F>Cl;
③电子的能层越大其能量越高,同一能层的电子,按s、p、d能量逐渐增大,所以能量高低:ns<(n+1)s,ns<np。


科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。

(1)若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为____,当有1.6g负极材料溶解时,转移的电子为____mol;
(2)若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为______→ __________(填电极材料,下同),溶液中的NO3-向________极移动;
(3)氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为________________。
Ⅱ.已知H-H 键、N-H 键、N≡N 键的键能分别为 436kJ/mol、391kJ/mol、946 kJ/mol,关于工业合成氨的反应,请根据键能的数据判断下列问题:
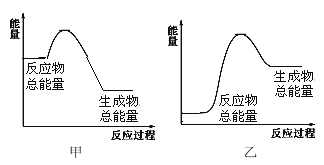
(4)若有 1 mol NH3生成 ,可________(填“吸收”或“放出”)热量________kJ;该反应的能量变化可用图__________表示。(填“甲“或“乙”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。已知:AlN+NaOH+H2O═NaAlO2+NH3↑
(方案 1)取一定量mg 的样品,用图1装置测定样品中AlN的纯度(夹持装置已略去)。
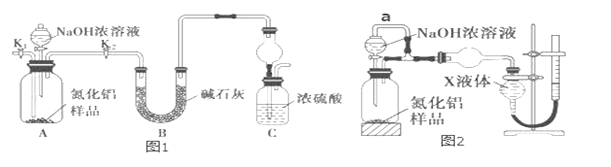
(1)如图 1,C 装置中球形干燥管的作用是_____。
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。接下来的实验操作是______________ ,打开分液漏斗活塞,加入 NaOH 浓溶液,至不再产生气体。打开 K1,通入氮气一段时间,测定 C 装置反应前后的质量变化。通入氮气的目的是___________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_____。
(方案 2)用图 2 装置测定 mg 样品中 AlN 的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是_____。(填字母序号)
a.CCl4 b.H2O c.NH4Cl 溶液 d.C6H6(苯)
(5)若 mg 样品完全反应,测得生成气体的体积为 VmL(已转换为标准状况),则 AlN 的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
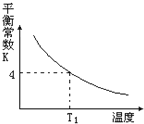
【题目】T2℃时,将1 mol X和2 mol Y投入2L的密闭容器中,发生反应:X(g)+2Y(g)![]() 3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
Y | 2 | 1.60 |
A. 前5 min用Z表示的平均反应速率为1.2mol/(L·min)
B. T2℃时,对于反应1/2X(g)+Y(g)![]() 3/2Z(g) △H’ 2ΔH’=ΔH
3/2Z(g) △H’ 2ΔH’=ΔH
C. T2℃时,若以1mol X、2mol Y和1mol Z充入上述容器中,达到平衡时X的体积分数比φ大
D. 该反应的正反应是吸热反应,且T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mLFeCl3溶液中使铜全部溶解(电路板上其他物质均不发生反应),测得电路板质量减少了3.2 g,在浸泡液中加足量的Fe粉并使之充分反应,过滤干燥固体,固体质量比加入的Fe粉质量减少了2.4g。
请计算:
(1)浸泡液中的溶质是__________(写化学式) 。
(2)参与反应的铁的质量是__________g。
(3)假设溶液的体积不变,最后所得溶液中c(Fe2+)=__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I按要求填空,括号内为有机物的结构简式或分子式
(1)有机物甲(![]() )中含氧官能团的名称是________________
)中含氧官能团的名称是________________
(2)有机物乙(分子式为C3H6O3)可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的乙为无色粘稠液体,易溶于水。乙的核磁共振氢谱如图 ,则乙的名称为______________
,则乙的名称为______________
(3)有机物丙(![]() )的反式1,4-加成聚合反应产物的结构简式为______________
)的反式1,4-加成聚合反应产物的结构简式为______________
(4)已知![]() 为平面结构,则有机物丁(
为平面结构,则有机物丁(![]() )分子中最多有_____个原子在同一平面内
)分子中最多有_____个原子在同一平面内
II化学式为C9H10O2的有机物有如下的转化关系:

已知:① F与FeCl3溶液能发生显色反应
②从G到H的反应中,H只有一种结构且能使溴水褪色。
③羟基与双键碳原子相连接时,不稳定,易发生转化:![]()
请回答下列问题:
(5)写出物质D的名称_______________
(6)B→C的反应类型:_____________________________。G→H反应类型:__________________
(7)A生成D和E的化学方程式:_______________________。
(8)有机物B与银氨溶液反应的离子方程式________________________。
(9)写出由苯酚合成 的合成路线流程图(无机试剂任选,要注明条件)_______
的合成路线流程图(无机试剂任选,要注明条件)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①金属和非金属化合形成离子键
②离子键是阳离子,阴离子的相互吸引
③两个非金属原子间不可能形成离子键
④非金属原子间不可能形成离子键
⑤离子化合物可能含有共价键
⑥共价化合物中可能有离子键
A. ![]() B.
B. ![]() C. ③ ⑤D.
C. ③ ⑤D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚丙烯酸脂类涂料是目前市场流行的涂料之一,它具有不易老化、耐擦洗,色泽亮丽等优点。聚丙烯酸酯的结构简式![]() ,则下列关于它的说法中正确的是( )
,则下列关于它的说法中正确的是( )
A. 它的结构属于体型结构 B. 它的单体是CH2=CHCOOR
C. 它能做防火衣服 D. 它是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
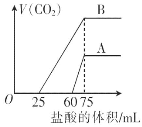
(1)原NaOH溶液的物质的量浓度为_______________。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是____________,其物质的量之比为___。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况下)的最大值为____mL。
(4)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。
已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-889.6 kJ·mol-1①
N2(g)+2O2(g)===2NO2(g)ΔH=+67.7 kJ·mol-1②
则CH4还原NO2生成水蒸气和氮气的热化学方程式是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com