
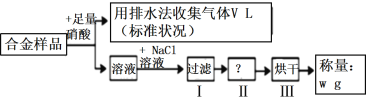
����Ŀ����.��ͼ������ͬѧ��Ƶ�һ������ԭ���װ�ã���ش��������⡣

(1)�� a�缫����Ϊ̼��b��ҺΪ FeCl3��Һ���������ĵ缫��ӦʽΪ____������1.6g���������ܽ�ʱ��ת�Ƶĵ���Ϊ____mol��
(2)�� a �缫����Ϊ����b��ҺΪŨ���ᣬ��������ָ��Ҳ��ƫת������ӵ�����Ϊ______�� __________����缫���ϣ���ͬ������Һ�е�NO3-��________���ƶ���
(3)����ȼ�ϵ�������ں���ɻ������ֵ����30%KOH��ҺΪ�������Һ������ʱ�ܷ�ӦΪ��2H2+O2=2H2O���������ĵ缫����ʽΪ________________��
����֪H-H ����N-H ����N��N ���ļ��ֱܷ�Ϊ 436kJ/mol��391kJ/mol��946 kJ/mol�����ڹ�ҵ�ϳɰ��ķ�Ӧ������ݼ��ܵ������ж��������⣺
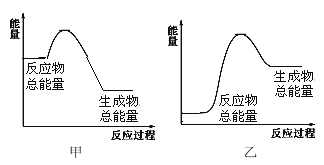
(4)���� 1 mol NH3���� ����________(���������������ų���������________kJ���÷�Ӧ�������仯����ͼ__________��ʾ����������������������
���𰸡�Fe3++e-=Fe2+ 0.05 ͭ(Cu) ��(Fe) ͭ(Cu) 2H2O+O2+4e-=4OH- �ų� 46 ��
��������
(1)��a�缫����Ϊ̼��b��ҺΪ FeCl3��Һ��CuΪ������CΪ�����������Ϸ�����ԭ��Ӧ������CuΪ+2�۽�����ÿ1molCu��Ӧ��ת��2mol���Ӽ��㣻
(2)��a�缫����Ϊ������һ���缫ΪCu������Fe��Ũ����ᷢ���ۻ���������b��ҺΪŨ���ᣬFeΪ������CuΪ�����������ɸ����������������������ƶ����������������ƶ���
(3)����ȼ�ϵ���ڼ��Ե������Һ�У�������O2��õ��ӱ�ΪOH-��
(4)��Ӧ��Ϊ�ϼ�����������ɼ��ų������IJ�ֵ�����������仯�жϷ�Ӧ�ȣ�����Ϸ��ȷ�Ӧ��Ӧ���������������������ߣ����ȷ�Ӧ��Ӧ�����������������������жϡ�
(1)��a�缫����Ϊ̼��b��ҺΪ FeCl3��Һ�������ڵ缫���Cu>C��CuΪ������CΪ�����������Ϸ�����ԭ��Ӧ����Һ�е�Fe3+��õ��ӣ��缫��ӦʽΪFe3++e-=Fe2+������CuΪ+2�۽�����ÿ1molCu��Ӧ��ת��2mol���Ӽ��㣬n(Cu)=1.6g��64g/mol=0.025mol�����Ե���ת�Ƶ����ʵ���Ϊn(e-)=2n(Cu)=0.05mol��
(2)��a�缫����Ϊ������һ���缫ΪCu��b��ҺΪŨ���ᣬ����Fe��Ũ����ᷢ���ۻ���������FeΪ������CuΪ�����������ɸ���Cu��������Fe������ͬ�ֵ����ų⣬���ֵ�������������������NO3-������ɽ϶ฺ��Cu�缫�ƶ���������������Fe�缫�ƶ���
(3)����ȼ�ϵ���ڼ��Ե������Һ�У�������O2��õ��ӱ�ΪOH-���缫��ӦʽΪ2H2O+O2+4e-=4OH-��
(4)����H-H ����N-H ����N��N ���ļ��ֱܷ�Ϊ 436kJ/mol��391kJ/mol��946 kJ/mol��N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) ��H=946kJ/mol��
NH3(g) ��H=946kJ/mol��![]() +436kJ/mol��
+436kJ/mol��![]() -391kJ/mol��3=-46 kJ/mol��˵������ 1 mol NH3���� ���ɷų�����46kJ����ӦΪ���ȷ�Ӧ��˵����Ӧ���������������������ߣ���˸÷�Ӧ�������仯����ͼ�ױ�ʾ��
-391kJ/mol��3=-46 kJ/mol��˵������ 1 mol NH3���� ���ɷų�����46kJ����ӦΪ���ȷ�Ӧ��˵����Ӧ���������������������ߣ���˸÷�Ӧ�������仯����ͼ�ױ�ʾ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������Һ�п��ܴ���Al3+��Fe2+��NH4+��Ba2+��Cl-��CO32-��SO42-��NO3-�е������֣���ȡ������Һ��������ʵ��
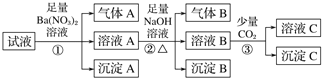
�����й��ж���ȷ����
A. ԭ��Һ��һ���У�Fe2+��Al3+��SO42-��NH4+��H+
B. ԭ��Һ��һ��û��Ba2+��CO32-��NO3-
C. ������з�Ӧ�����ӷ���ʽΪ2AlO2����CO2��3H2O=2Al(OH)3����CO32-
D. ����A��B֮��϶����ܷ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת����ϵ�У���AΪʯ�͵��ѽ����ﺬ���ϸߵ����壨̼Ԫ�ص���������Ϊ0.857��,B�����к�����Ԫ��������ʽΪC2H4O��1molD������Zn��Ӧ����22.4LH2����״������EΪ��Ԫ���������ش��������⣺
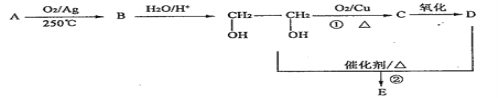
��1��A �Ľṹ��ʽ____________��
��2���ٵķ�Ӧ����Ϊ___________��
��3��D�й����ŵ�������____________��
��4��д����Ӧ�ڵĻ�ѧ����ʽ___________��
������W�������߷������ͼ���һ�ֺϳ�·�����£�
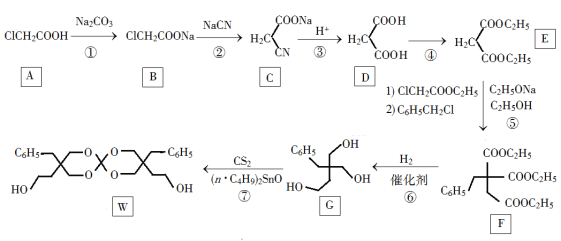
��1��A�Ļ�ѧ����Ϊ________��
��2���ڵķ�Ӧ������__________��
��3��G�ķ���ʽΪ________��
��4��д����E��Ϊͬ���칹����������Ľṹ��ʽ���˴Ź�������Ϊ����壬�������Ϊ1��1��______________����д��һ�ּ��ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾԪ�����ڱ�ǰ�����ڵ�һ���֣�����Ԫ��X��Y��Z��W��������ȷ���ǣ� ��

��X��Y������������ˮ��������ΪY��X����Y��Z����̬�⻯����ȶ���Y��Z����W�ĵ��ʳ����³�Һ̬��һ�������¿������۷�Ӧ����W��ԭ��������Z��9��
A. ֻ�Т� B. �٢� C. �٢ڢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Cu��Ag�����ܽ��������У�ijͬѧ�������ʵ�����m gͭ���Ͻ���Ʒ��ͭ����������������˵������ȷ����(����)
A. ��Cu��ԭ������Ϊ![]() molB. ����I���õ��IJ����������ձ�������������
molB. ����I���õ��IJ����������ձ�������������
C. ������Ϊ����D. ͭ����������Ϊ![]() ��100%
��100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ�з�Ӧ�����������У�AsH3��H2SO4��KBrO3��K2SO4��H3AsO4��H2O��һ��δ֪����X��
��1����֪KBrO3�ڷ�Ӧ�еõ����ӣ���÷�Ӧ�Ļ�ԭ����__________________��
��2����֪0.2 mol KBrO3�ڷ�Ӧ�еõ�1 mol��������X����X�Ļ�ѧʽΪ_____________��
��3������������Ӧ����֪__________________��
A�������ԣ�KBrO3��H3AsO4 B�������ԣ�H3AsO4��KBrO3
C����ԭ�ԣ�AsH3��X D����ԭ�ԣ�X��AsH3
��4�����������ͻ�ԭ���Ļ�ѧʽ������ƽ���ϵ���������з����У����������ת�Ƶķ������Ŀ����ע����һ���õ����ű�ʾ��������˫���ű�ʾ�IJ��÷֣�__________________��
��5��KClO3���ԺͲ��ᣨH2C2O4�������ᷴӦ���ɸ�Ч������ɱ����ClO2��������CO2��KHSO4�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�
a | b | c | |||||||||||||||
e | f | ||||||||||||||||
�Իش��������⣺
��1��д��Ԫ��e�Ļ�̬ԭ�ӵ����Ų�ʽ________________����δ�ɶԵ�����Ϊ________��
��2��c�ڿ�����ȼ�ղ���ķ��ӹ���Ϊ_____������ԭ�ӵ��ӻ���ʽΪ______�ӻ���c���γ�һ�ְ�Ԫ��״��ͬ���ڵĵ��ʷ��ӣ�ԭ�ӵ��ӻ���ʽΪ______�ӻ���
��3��b���ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ��
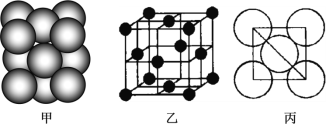
����֪b��ԭ�Ӱ뾶Ϊd���ף�NA���������ӵ�������b�����ԭ������ΪM����ش�
�پ�����bԭ�ӵ���λ��Ϊ_____����ʾԭ�ӿռ�ռ���ʵĴ���ʽΪ_____________��
�ڸþ�����ܶ�Ϊ_____________g/cm3���ú��й���ĸ�Ĵ���ʽ��ʾ����a��f�У��뵥��b������ԭ�ӵĶѻ���ʽ��ͬ����__________����Ԫ�ط��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ȷ����
A. H��D��T��Ϊͬ��������B. ������Ϊ20����ԭ�ӣ�2017Cl
C. ���Ȼ�̼�ĵ���ʽ��![]() D. Cl���Ľṹʾ��ͼ��
D. Cl���Ľṹʾ��ͼ��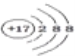
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������г�����һЩԭ�ӵ�2p�ܼ���3d�ܼ��е����Ų�����������жϣ�Υ��������ԭ������_____��Υ���˺��ع������______��
![]()
��2��ijԪ�صļ���̬�����ȶ�״̬��ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s13p33d2�����Ԫ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ________��������������Ӧˮ����Ļ�ѧʽ��________��
��3���÷��š�������������=����ʾ���и����ϵ��
�ٵ�һ�����ܣ�Na________Mg��Mg________Ca��
�ڵ縺�ԣ�O________F��F________Cl��
�������ߵͣ�ns________��n+1��s��ns________np��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com