
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________。
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
【答案】AsH3Br2AC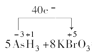 2KClO3+H2C2O4+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+2H2O
2KClO3+H2C2O4+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+2H2O
【解析】
(1)KBrO3在反应中得到电子,所以KBrO3化合价降低是氧化剂,AsH3变成了H3AsO4,所以AsH3是还原剂;
(2)设X中溴元素的化合价为x,则0.2mol(5-x)=1mol,所以x=0,故X为Br2;
(3)A、反应中KBrO3是氧化剂,H3AsO4是氧化产物,氧化性为KBrO3>H3AsO4,故A正确,B错误;C、AsH3是还原剂,X是还原产物,所以还原性AsH3>X,故C正确,故D错误;答案选AC;
(4)KBrO3在反应中得到电子,AsH3失去电子,转移的电子数为40e-,则标出电子转移的方向和数目为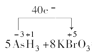 ;
;
(5)KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,反应的方程式为:2KClO3+H2C2O4+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+2H2O。


科目:高中化学 来源: 题型:
【题目】下列溶液中所含c(Cl-)最大的是
A. 50mL0.1mol·L-1AlCl3溶液 B. 100mL0.1 mol·L-1MgCl2溶液
C. 150mL0.3 mol·L-1KClO3溶液 D. 200mL0.2 mol·L-1NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物分子中双键上的碳原子与其他原子(或原子团)直接结合生成新的化合物分子的反应是加成反应,下列过程与加成反应无关的是( )
A.甲烷与氯气的混合气体在光照条件下颜色变浅
B.乙烯与溴水混合振荡,水层颜色褪去
C.乙烯与水在一定条件下反应制取乙醇
D.乙烯与氯化氢在一定条件下反应制取纯净的一氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。

(1)若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为____,当有1.6g负极材料溶解时,转移的电子为____mol;
(2)若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为______→ __________(填电极材料,下同),溶液中的NO3-向________极移动;
(3)氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为________________。
Ⅱ.已知H-H 键、N-H 键、N≡N 键的键能分别为 436kJ/mol、391kJ/mol、946 kJ/mol,关于工业合成氨的反应,请根据键能的数据判断下列问题:
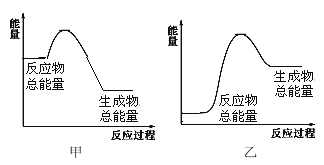
(4)若有 1 mol NH3生成 ,可________(填“吸收”或“放出”)热量________kJ;该反应的能量变化可用图__________表示。(填“甲“或“乙”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质周期性变化的根本原因是( )
A.原子半径的周期性变化B.化合价的周期性变化
C.金属性和非金属性的周期性变化D.核外电子排布的周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值,下列说法正确的是
A. 16g 18O2含有N A个18O原子
B. 标准状况下,11.2 L C2H6中含有C—C键的数目为2NA
C. 等质量的1H218O 与 D216O,所含中子数相等
D. 足量Mg与2.8g N2 完全反应后失去0.2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I按要求填空,括号内为有机物的结构简式或分子式
(1)有机物甲(![]() )中含氧官能团的名称是________________
)中含氧官能团的名称是________________
(2)有机物乙(分子式为C3H6O3)可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的乙为无色粘稠液体,易溶于水。乙的核磁共振氢谱如图 ,则乙的名称为______________
,则乙的名称为______________
(3)有机物丙(![]() )的反式1,4-加成聚合反应产物的结构简式为______________
)的反式1,4-加成聚合反应产物的结构简式为______________
(4)已知![]() 为平面结构,则有机物丁(
为平面结构,则有机物丁(![]() )分子中最多有_____个原子在同一平面内
)分子中最多有_____个原子在同一平面内
II化学式为C9H10O2的有机物有如下的转化关系:

已知:① F与FeCl3溶液能发生显色反应
②从G到H的反应中,H只有一种结构且能使溴水褪色。
③羟基与双键碳原子相连接时,不稳定,易发生转化:![]()
请回答下列问题:
(5)写出物质D的名称_______________
(6)B→C的反应类型:_____________________________。G→H反应类型:__________________
(7)A生成D和E的化学方程式:_______________________。
(8)有机物B与银氨溶液反应的离子方程式________________________。
(9)写出由苯酚合成 的合成路线流程图(无机试剂任选,要注明条件)_______
的合成路线流程图(无机试剂任选,要注明条件)_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com