
����Ŀ����һ�ݻ�Ϊ2 L���ܱ������ڼ���0.2 mol N2��0.6 mol H2����һ�������·������·�Ӧ��N2(g)��3H2(g)![]() 2NH3 ��H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ��
2NH3 ��H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ��

��1������ͼʾ������ӷ�Ӧ��ʼ����4���Ӵﵽƽ��ʱ��ƽ����Ӧ������(N2)Ϊ__________��
��2���ﵽƽ���5����ĩ�������������������䣬ֻ�ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ_____________��
a��0.20 mol/L b��0.12 mol/L c��0.10 mol/L d��0.08 mol/L
��3���ﵽƽ���5����ĩ�������������������䣬ֻ�������������С����ƽ��ʱNH3��Ũ��ǡ��Ϊԭ����2�����������_____(ѡ����ڡ��������ڡ�����С�ڡ�)����֮һ����ԭ�������ѧƽ�ⳣ��________(ѡ���������С�����䡱)��
��4���ڵ�5����ĩ�������������Сһ�룬���ڵ�8����ĩ�ﵽ�µ�ƽ��(��ʱNH3��Ũ��ԼΪ0.25 mol/L)������ͼ�л�����5����ĩ������ƽ��ʱNH3Ũ�ȵı仯����_____��
���𰸡� 0.0125mol��L��1��min��1 ac ���� ���� 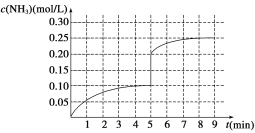
�����������⿼���˻�ѧ��Ӧ���ʵĶ�����ʾ�����ͻ�ѧƽ�ⳣ������ѧƽ���Ӱ�����ص�֪ʶ�㣬ͬһ��ѧ��Ӧ�л�ѧƽ�ⳣ��ֻ���¶��йأ��뷴Ӧ��������Ũ���ء�
(1)4�����ڰ����ķ�Ӧ����Ϊ0.10/4=0.025 mol��L��1��min��1�����ݻ�ѧ��������ϵ���㵪��������Ϊ 0.0125mol��L��1��min��1�� (2)�÷�Ӧ�ǿ��淴Ӧ�����Է�Ӧ�ﲻ����ȫת�����������������Ũ�Ȳ�����Ϊ0.20 mol��L��1����Ӧ���ȣ������¶ȣ�ƽ���������ƶ��������¶ȣ�ƽ���������ƶ�����������Ũ�Ȳ�����Ϊ0.10 mol��L��1����ѡac��(3) �ﵽƽ���5����ĩ�������������������䣬ֻ�������������С��ƽ���������ƶ�����ƽ��ʱNH3��Ũ��ǡ��Ϊԭ����2�������������ʵ������ӣ�����������������ڶ���֮һ����ԭ�������������û�иı��¶ȣ�����ƽ�ⳣ�����䣻 (4) �ڵ�5����ĩ�������������Сһ�룬��Ũ�ȱ�Ϊԭ����2����ƽ�������ƶ���������Ũ�����������ڵ�8����ĩ�ﵽ�µ�ƽ��(��ʱNH3��Ũ��ԼΪ0.25 mol/L)����NH3Ũ�ȵı仯������ͼ�� ��
��


 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ʵ�顣
��1�������������ơ��ء�þ������1�˷ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ������__�����ᷴӦ����ң�___�����ᷴӦ���ٶ�������__�����ᷴӦ������������ࡣ
��2����H2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�Sǿ����Ӧ�����ӷ���ʽΪ_______
��������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯����
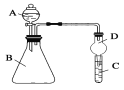
��3������A������Ϊ________
��4����Ҫ֤���ǽ����ԣ�Cl>I����A�м�Ũ���ᣬB�м�KMnO4(KMnO4��Ũ���᳣���·�Ӧ��������)��C�мӵ����⻯�ػ����Һ���۲쵽C����Һ_____(������)������֤��
��5����Ҫ֤���ǽ����ԣ�C>Si������A�м����ᡢB�м�CaCO3��C�м�Na2SiO3��Һ�۲쵽C��_______(������)������֤�������е�ͬѧ��Ϊ������лӷ��ԣ��ɽ���C�и������飬Ӧ����װ�ü�����װ��_______��Һ��ϴ��ƿ��ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾԪ�����ڱ�ǰ�����ڵ�һ���֣�����Ԫ��X��Y��Z��W��������ȷ���ǣ� ��

��X��Y������������ˮ��������ΪY��X����Y��Z����̬�⻯����ȶ���Y��Z����W�ĵ��ʳ����³�Һ̬��һ�������¿������۷�Ӧ����W��ԭ��������Z��9��
A. ֻ�Т� B. �٢� C. �٢ڢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ�з�Ӧ�����������У�AsH3��H2SO4��KBrO3��K2SO4��H3AsO4��H2O��һ��δ֪����X��
��1����֪KBrO3�ڷ�Ӧ�еõ����ӣ���÷�Ӧ�Ļ�ԭ����__________________��
��2����֪0.2 mol KBrO3�ڷ�Ӧ�еõ�1 mol��������X����X�Ļ�ѧʽΪ_____________��
��3������������Ӧ����֪__________________��
A�������ԣ�KBrO3��H3AsO4 B�������ԣ�H3AsO4��KBrO3
C����ԭ�ԣ�AsH3��X D����ԭ�ԣ�X��AsH3
��4�����������ͻ�ԭ���Ļ�ѧʽ������ƽ���ϵ���������з����У����������ת�Ƶķ������Ŀ����ע����һ���õ����ű�ʾ��������˫���ű�ʾ�IJ��÷֣�__________________��
��5��KClO3���ԺͲ��ᣨH2C2O4�������ᷴӦ���ɸ�Ч������ɱ����ClO2��������CO2��KHSO4�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�
a | b | c | |||||||||||||||
e | f | ||||||||||||||||
�Իش��������⣺
��1��д��Ԫ��e�Ļ�̬ԭ�ӵ����Ų�ʽ________________����δ�ɶԵ�����Ϊ________��
��2��c�ڿ�����ȼ�ղ���ķ��ӹ���Ϊ_____������ԭ�ӵ��ӻ���ʽΪ______�ӻ���c���γ�һ�ְ�Ԫ��״��ͬ���ڵĵ��ʷ��ӣ�ԭ�ӵ��ӻ���ʽΪ______�ӻ���
��3��b���ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ��
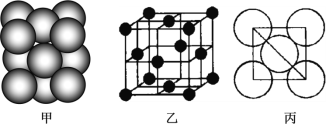
����֪b��ԭ�Ӱ뾶Ϊd���ף�NA���������ӵ�������b�����ԭ������ΪM����ش�
�پ�����bԭ�ӵ���λ��Ϊ_____����ʾԭ�ӿռ�ռ���ʵĴ���ʽΪ_____________��
�ڸþ�����ܶ�Ϊ_____________g/cm3���ú��й���ĸ�Ĵ���ʽ��ʾ����a��f�У��뵥��b������ԭ�ӵĶѻ���ʽ��ͬ����__________����Ԫ�ط��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�ij��ȤС���������ͼ��ʾװ��(���ּг�װ������ȥ)����ʵ��̽����
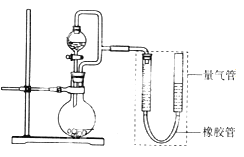
��ʵ��һ��̽��Ӱ�컯ѧ��Ӧ���ʵ����ء�
Բ����ƿ��װпƬ(����ʵ��������пƬ��С��������ͬ)����ѹ��Һ©����װϡ���ᣬ������20.0mL����Ϊ��ʱ�յ㣬���Ϊt1��t2��
��� | V(H2SO4)/mL | c(H2SO4)/mol��L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
��� | V(H2SO4)/mL | c(H2SO4)/mol��L��1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
����װ�������Եķ�����_______________________________________________��
�Ƚ�ʵ��I�͢���Եó��Ľ�����____________________________________________��
��ʵ�����̽�����ĵ绯ѧ��ʴ��
��Բ����ƿ��װ���ۺ�̼�ۻ�����ѹ��Һ©����װϡ���ᣬ��������ϡ������������г��ֵ������ǣ����Һ��_________�Ҳ�Һ��_________(ѡ������������½���)��
��Բ����ƿ��װ�����ͬ�������۵�������̼�ۣ������Լ��Ͳ�����ͬ���������Ҳ�Һ��仯��_______��ѡ��족������������ͬ����˵��ԭ��ط�Ӧ��һ�㻯ѧ��Ӧ_______��
��Բ����ƿ��װ�����ͬ�������ۺ�̼�ۻ�����ѹ��Һ©����װʳ��ˮ����������ʳ��ˮ����Ԥ���������г��ֵ������ǣ�___________________________________�������ĵ缫��Ӧ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ȷ����
A. H��D��T��Ϊͬ��������B. ������Ϊ20����ԭ�ӣ�2017Cl
C. ���Ȼ�̼�ĵ���ʽ��![]() D. Cl���Ľṹʾ��ͼ��
D. Cl���Ľṹʾ��ͼ��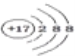
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڳ�����Ũ�Ⱦ�Ϊ0.1 mol��L��1������ʹ�����Һ������˵����ȷ����
A. c(CH3COO��)=c(Cl��)
B. ������Һ��pHС������
C. ����ĵ��뷽��ʽ��CH3COOH��CH3COO����H+
D. �����ʵ���Ũ�ȡ������������������������Һ��Ϻ���Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M��һ����Ҫ���ϵ��м��壬�ṹ��ʽΪ��![]() ���ϳ�M��һ��;�����£�
���ϳ�M��һ��;�����£�
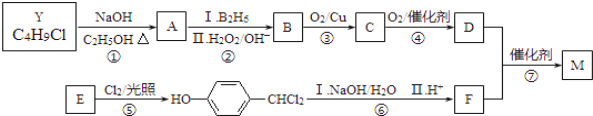
A��F�ֱ����һ���л�������ϳ�·���еIJ��ֲ��P��Ӧ��������ȥ��
��֪����Y�ĺ˴Ź�������ֻ��1�ַ壻
��RCH=CH2 ![]() RCH2CH2OH��
RCH2CH2OH��
�������ǻ�������ͬһ��̼ԭ���ϲ��ȶ�������ˮ��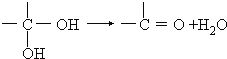
��ش��������⣺
��1��Y�Ľṹ��ʽ��________��D�Ĺ�������Ϊ________��
��2������ٵĻ�ѧ��Ӧ����ʽ��________��
��3������ݵķ�Ӧ������________��
��4��д��������еڢ�ѧ��Ӧ����ʽ��________��
��5������˵������ȷ����________��
a��A��E���ܷ���������Ӧ b��1molB��ȫȼ����6mol O2
c��C��������������ͭ����Һ��Ӧ d��1molF�������3mol H2��Ӧ
��6��M���������õ�X��C11H12O4����X��ͬ���칹����ͬʱ�������������Ľṹ��ʽΪ________��
a��������ֻ������ȡ�����������ϵ�һ�ȴ�����2��
b��ˮ��ֻ���ɷ��㴼�Ͷ�Ԫ�ᣬ�Ҷ�Ԫ��ĺ˴Ź�������ֻ��2�ַ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com