
【题目】设 NA为阿伏加德罗常数的值,下列说法正确的是
A. 16g 18O2含有N A个18O原子
B. 标准状况下,11.2 L C2H6中含有C—C键的数目为2NA
C. 等质量的1H218O 与 D216O,所含中子数相等
D. 足量Mg与2.8g N2 完全反应后失去0.2NA电子
【答案】C
【解析】
A. 16g 18O2中氧原子的物质的量为![]() =
=![]() mol,则该分子中含有
mol,则该分子中含有![]() NA个18O原子,A项错误;
NA个18O原子,A项错误;
B.1mol C2H6中含1mol 碳碳单键,标准状况下,11.2 L C2H6即0.5mol乙烷中含有C—C键的数目为0.5NA,B项错误;
C. 1H218O与D216O的摩尔质量均为20g/mol,1mol1H218O与D216O分子内所含中子的物质的量均为10 mol,又两者为等质量,则分子的物质的量相同,所含的中子数相同,C项正确;
D.镁与氮气反应的化学方程式为:N2+3Mg![]() Mg3N2,2.8g N2的物质的量为
Mg3N2,2.8g N2的物质的量为![]() = 0.1mol,失去电子数为0.1×6×NA=0.6NA,D项错误;
= 0.1mol,失去电子数为0.1×6×NA=0.6NA,D项错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某探究小组用盐酸与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HCl浓度为1.00mol/L、2.50mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、40℃,每次实验盐酸的用量为25.00mL,大理石用量为10.00g。
(1)写出盐酸与大理石反应的化学方程式________
(2)请完成以下实验设计表,并把实验中空缺处补充完整:
实验 编号 | 温度 (℃) | 大理石 规格 | HCl浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.50 | (I)实验①和②探究温度对反应速率的影响; (II)实验①和③探究浓度对反应速率的影响; (III)实验①和④探究______对反应速率的影响 |
② | __ | 粗颗粒 | 2.50 | |
③ | 25 | 粗颗粒 | ___ | |
④ | 25 | 细颗粒 | 2.50 |
(3)实验①中CO2质量随时间变化的关系见下图。计算实验①中70s-90s范围内用HCl表示的平均反应速率 ______(忽略溶液体积变化)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________。
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究。
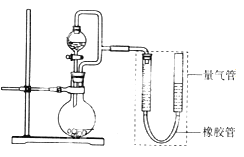
(实验一)探究影响化学反应速率的因素。
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
检查该装置气密性的方法是_______________________________________________。
比较实验I和Ⅱ可以得出的结论是____________________________________________。
(实验二)探究铁的电化学腐蚀。
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面_________右侧液面_________(选填“上升”、“下降”)。
②圆底烧瓶中装与①相同量的铁粉但不加入碳粉,其他试剂和操作相同,发现左、右侧液面变化较_______(选填“快”、“慢”,下同),说明原电池反应比一般化学反应_______。
③圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:___________________________________,正极的电极反应是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含的杂质。选用的试剂正确的是
选项 | 物质(杂质) | 试剂 |
A | Al2O3(SiO2) | 过量NaOH溶液 |
B | CO2(HCl) | 饱和Na2CO3溶液 |
C | Al2O3(Fe2O3) | Al粉/加热 |
D | Na2O2(Na2O) | O2/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下浓度均为0.1 mol·Lˉ1的盐酸和醋酸溶液,下列说法正确的是
A. c(CH3COOˉ)=c(Clˉ)
B. 醋酸溶液的pH小于盐酸
C. 醋酸的电离方程式:CH3COOH=CH3COOˉ+H+
D. 等物质的量浓度、等体积的盐酸与氢氧化钠溶液混合后溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组研究混有少量氯化钠杂质的纯碱样品,设计如下装置来测定该纯碱样品的纯度。实验步骤如下:
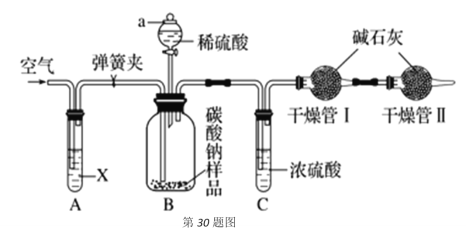
①组装好仪器并检查气密性;
②用托盘天平称量干燥管Ⅰ的质量为m1;
③称量纯碱样品的质量为n,装入广口瓶B内;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤往试管A缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的质量为m2。
请回答:
(1)试剂X是__________,写出广口瓶B中反应的化学方程式__________。
(2)干燥管Ⅱ的作用是__________。
(3)步骤④若滴入稀硫酸过快,会导致测定结果__________(填“偏大”、“偏小”或者“不变”);理由是__________。
(4)根据此实验,计算纯碱样品纯度的为__________(用含m1、m2、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com