
【题目】下列溶液中所含c(Cl-)最大的是
A. 50mL0.1mol·L-1AlCl3溶液 B. 100mL0.1 mol·L-1MgCl2溶液
C. 150mL0.3 mol·L-1KClO3溶液 D. 200mL0.2 mol·L-1NaCl溶液
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】从单质氟到碘,下列情况中不能反映出它们的氧化性强弱不同的是( )
A.单质与卤化物之间的置换情况
B.与氢气反应的情况
C.与硝酸银反应生成卤化银的颜色情况
D.与水反应的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”—钛酸钡( BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiCl4在常温下是无色液体,遇水容易发生水解:TiC14+2H2O=TiO2+4HCl
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为_________________,此反应的平衡常数K=__________(填写计算结果)。若不考虑CO32-的水解,则至少需要使用_______mol/L的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)配制TiC14溶液时通常将TiC14固体溶于浓盐酸再加水稀释,其目的是______________。
(3)可循环使用的物质X是____________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:____________________。
(4)写出煅烧草酸氧钛钡晶体的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
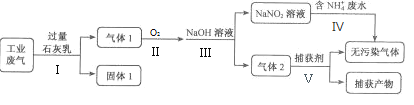
已知::2NO2+2NaOH=NaNO3+NaNO2+H2O;NO+NO2+2NaOH=2NaNO2+H2O。
(1)固体1的主要成分除Ca(OH)2外,还有__________ 、________ (填化学式);
(2)步骤Ⅱ中需要的O2量应是_____(填“少量”或“过量”);步骤Ⅴ最终捕获剂捕获的气体产物是________;
(3)步骤Ⅳ处理含NH4+废水时,发生反应的离子方程式为__________________;
(4)为确保步骤Ⅲ无NaNO3生成,理论上应控制NO与O2的物质的量之比为_____,若n(NO) :n(O2)=5:2且NaOH溶液足量,则步骤Ⅲ所得溶液中NaNO3与NaNO2的物质的量之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验
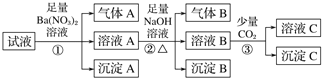
下列有关判断正确的是
A. 原溶液中一定有.Fe2+、Al3+、SO42-、NH4+、H+
B. 原溶液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中反应的离子方程式为2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 气体A、B之间肯定不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同条件下,等物质的量的SO2与SO3相比较,下列结论中不正确的是
A. 分子数之比为1∶1 B. 原子总数之比为3∶4
C. 质量之比为4∶5 D. 密度之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将外观相近的钠、钾、镁、铝各1克分别投入到足量的同浓度的盐酸中,试预测实验结果:__与盐酸反应最剧烈,___与盐酸反应的速度最慢;__与盐酸反应产生的气体最多。
(2)向H2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律
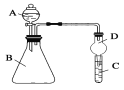
(3)仪器A的名称为________
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____(填现象),即可证明
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有_______溶液的洗气瓶除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组用盐酸与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HCl浓度为1.00mol/L、2.50mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、40℃,每次实验盐酸的用量为25.00mL,大理石用量为10.00g。
(1)写出盐酸与大理石反应的化学方程式________
(2)请完成以下实验设计表,并把实验中空缺处补充完整:
实验 编号 | 温度 (℃) | 大理石 规格 | HCl浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.50 | (I)实验①和②探究温度对反应速率的影响; (II)实验①和③探究浓度对反应速率的影响; (III)实验①和④探究______对反应速率的影响 |
② | __ | 粗颗粒 | 2.50 | |
③ | 25 | 粗颗粒 | ___ | |
④ | 25 | 细颗粒 | 2.50 |
(3)实验①中CO2质量随时间变化的关系见下图。计算实验①中70s-90s范围内用HCl表示的平均反应速率 ______(忽略溶液体积变化)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
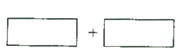
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________。
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com