
【题目】元素性质周期性变化的根本原因是( )
A.原子半径的周期性变化B.化合价的周期性变化
C.金属性和非金属性的周期性变化D.核外电子排布的周期性变化
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】在相同条件下,等物质的量的SO2与SO3相比较,下列结论中不正确的是
A. 分子数之比为1∶1 B. 原子总数之比为3∶4
C. 质量之比为4∶5 D. 密度之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的化学电源在日常生活和高科技领域中都有广泛应用,有关以上化学电源说法错误的是( )
A. 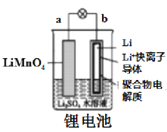 图中:放电时,溶液中Li+从a向b迁移
图中:放电时,溶液中Li+从a向b迁移
B. 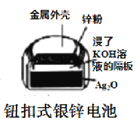 图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
C. 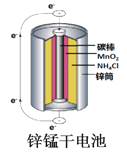 图中:锌筒作负极,发生氧化反应,锌筒会变薄
图中:锌筒作负极,发生氧化反应,锌筒会变薄
D. 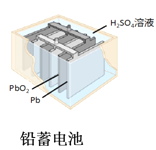 图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量Fe、FeO和Fe2O3的混合物中加入150 mL一定浓度的稀硝酸恰好使混合物完全溶解,同时可得到标准状况下1.12 L NO气体。向所得到的溶液中再加入KSCN溶液,无红色出现。若用足量的CO在加热条件下还原相同质量的混合物得到11.2 g铁单质。下列说法正确的是( )
A. 往所得溶液中加入KSCN溶液,无红色出现,则溶液中无Fe2+
B. 原稀硝酸的物质的量浓度为3mol/L
C. 能确定铁和三氧化二铁的物质的量之比
D. 混合物中铁单质为0.075mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
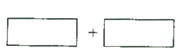
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________。
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2-都能与MnO4—反应生成NO3-。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示:
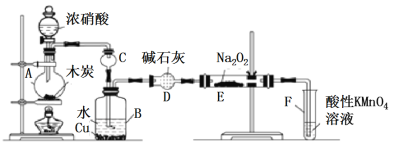
(1)A中反应的化学方程式_____________;
(2)装置B中观察到的主要现象______________;
(3)仪器D的名称是___________________;
(4)A中滴入浓硝酸之前,应先通入N2一段时间,原因是____________;
(5)写出NO被酸性KMnO4氧化的离子反应方程式______________;
(6)若无装置D,则E中产物除NaNO2外,还有_______(填化学式)。
Ⅱ.某研究性学习小组对NO2与Na2O2能否发生反应进行探究。
步骤1:提出假设
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:______________________________________________。
步骤2:设计实验
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选) | 预期的实验现象及结论 |
取适量的白色固体置于试管中,加蒸馏水溶解, ①__________________________________________ | ②___________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究。
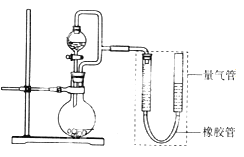
(实验一)探究影响化学反应速率的因素。
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
序号 | V(H2SO4)/mL | c(H2SO4)/mol·L-1 | t/s | ||||
I | 40 | 1 | t1 | ||||
II | 40 | 3 | t2 | ||||
检查该装置气密性的方法是_______________________________________________。
比较实验I和Ⅱ可以得出的结论是____________________________________________。
(实验二)探究铁的电化学腐蚀。
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面_________右侧液面_________(选填“上升”、“下降”)。
②圆底烧瓶中装与①相同量的铁粉但不加入碳粉,其他试剂和操作相同,发现左、右侧液面变化较_______(选填“快”、“慢”,下同),说明原电池反应比一般化学反应_______。
③圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:___________________________________,正极的电极反应是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含的杂质。选用的试剂正确的是
选项 | 物质(杂质) | 试剂 |
A | Al2O3(SiO2) | 过量NaOH溶液 |
B | CO2(HCl) | 饱和Na2CO3溶液 |
C | Al2O3(Fe2O3) | Al粉/加热 |
D | Na2O2(Na2O) | O2/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个恒温、恒容密闭容器中,有两个可左右自由滑动的密封隔板(a、b),将容器分成三部分,已知充入的三种气体质量相等,当隔板静止时,容器内气体所占体积如图所示,下列说法中错误的是
![]()
A. 若Y是O2 ,则X可能是CH4 B. 分子数目:X=Z=2Y
C. 若X是N2,则Z可能是CO D. 气体密度:X=Z=2Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com