
【题目】在恒温恒容的密闭容器中通入lmolX和2molY,发生下列反应:X(g)+2Y(g)![]() M(g)+2N(g) △H=akJ/mol(a>0),下列说法中正确的是
M(g)+2N(g) △H=akJ/mol(a>0),下列说法中正确的是
A. 到达平衡状态时,加入催化剂,平衡不移动,反应速率也不会发生改变
B. 反应达到平衡时,X和Y的转化率相等
C. v正(X)=2v逆(N)时,反应到达平衡状态
D. 到达平衡状态时,反应吸收akJ能量
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的一种新型可充放电 AGDIB 电池(铝-石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为 CxPF6+LiyAl=Cx+LiPF6+Liy-1+Al。放电过程如图,下列说法正确的是
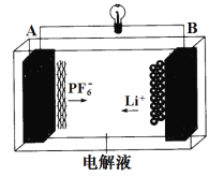
A. B为负极,放电时铝失电子
B. 电解液可以用常规锂盐和水代替
C. 充电时 A 电极反应式为 Cx + PF6- - e-= CxPF6
D. 废旧 AGDIB 电池进行“放电处理”时,若转移 1mol 电子,石墨电极上可回收 7gLi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A2+B2=2AB的反应历程可以看作如下(△H表示该过程的能量变化):
Ⅰ.A2=A+A △H1
Ⅱ.B2=B+B △H2
Ⅲ.A+B=AB △H3
则下列说法中正确的是
A. 当△H3+(△H1+△H2)>0时,该反应是吸热反应
B. 当2△H3+(△H1+△H2)>0时,该反应是放热反应
C. 当2△H3+(△H1+△H2)<0时,该反应是放热反应
D. 当△H3+(△H1+△H2)<0时,该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,不合理的是( )

A. 洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干
B. 用CCl4提取碘水中的碘,选③
C. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D. 粗盐提纯,选①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)1.01×105Pa、0℃时气态单质Xn的密度为d g/L,则X的相对原子质量为________。
(2)NO和O2可发生反应:2NO+O2=2NO2,现有amolNO和bmolO2充分反应后氮原子与氧原子的个数比为_____。
(3)已知铝的相对原子质量为27,若阿伏加德罗常数取6.02×1023mol-1,则可估算一个铝原子的质量约为________g。
(4)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,那么c g氧气在标准状况下的体积约是______(用含NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、 医药以及原子能工业中有广泛应用。以 Na2SO3、SO2、HCHO 和锌粉为原料制备次硫酸氢钠甲醛的 实验装置如下图所示:

实验步骤:
步骤 1:在三颈烧瓶中加入一定量 Na2SO3 和水,搅拌溶解,
缓慢通入 SO2,至溶液 pH 约为 4,制得 NaHSO3 溶液;
步骤 2:将装置 A 中导气管换成橡皮塞。向烧瓶中加入稍过量 的锌粉和一定量甲醛溶液,在 80~90℃下,反应约 3h,冷却 至室温,抽滤;
步骤 3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置 B 的烧杯中应加入的溶液是____________;冷凝管中冷却水从____________(填“a”或“b”)口进 水。
(2)A 中多孔球泡的作用是____________。
(3)写出步骤 2 中发生反应的化学方程式____________。
(4)步骤 3 中在真空容器中蒸发浓缩的原因是是防止温度过高使产物分解,也防止____________。
(5)为了测定产品的纯度,准确称取 2.0g 样品,完全溶于水配成 100mL 溶液,取 20.00mL 所配溶 液,加入过量碘完全反应后(已知 I2 不能氧化甲醛,杂质不反应),加入 BaCl2 溶液至沉淀完全,过 滤、洗涤、干燥至恒重得到白色固体 0.466g。M(NaHSO2·HCHO·2H2O)=154g/mol]
①如何检验沉淀是否洗净____________。
②则所制得的产品的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如下图所示位置,V甲:V乙=4:1(两侧温度、压强均相同)。则混合气体中CO和CO2的物质的量比为( )

A. 1:1 B. 1:3 C. 3:1 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青海是我国最大的钾盐产地,某厂制得的钾盐(主要成分为KCl)混有MgCl2、CaCl2、K2SO4以及泥沙等杂质,以下是粗钾盐提纯的实验方案,各步操作流程如图,可以选用的试剂为:NaOH溶液、KOH溶液、Ba(OH)2溶液、HCl溶液、H2SO4溶液、HNO3溶液、Na2CO3溶液、K2CO3溶液

(1)过量Ca(OH)2的作用是除去溶液中的Mg2+,写出该反应的化学方程式___________。
(2)操作①和操作②都需用到玻璃棒,分别写出玻璃棒在操作①和操作②中的作用___________,_______________。
(3)试剂①、试剂②、试剂③分别为__________,____________,______________。若在操作②之前加入试剂③有什么后果___________________________________。
(4)若发现滤液浑浊,应如何操作___________________________________________。
(5)沉淀的成分有:泥沙、Mg(OH)2、BaSO4、CaCO3和_______________。
(6)除杂试剂需过量,但过量的试剂最后仍然要除去。过量的试剂③是如何除去的________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com