
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体),向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示,下列分析或结果错误的是
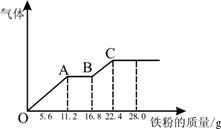 A.H2SO4浓度为4mol•L—1
A.H2SO4浓度为4mol•L—1
B.OA段产生的是NO,AB段的反应为
Fe+2Fe3+=3Fe2+,BC段产生氢气
C.每份混合酸中NO3—物质的量为0.3mol
D.第二份溶液中最终溶质为FeSO4
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中: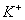 、
、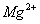 、
、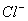 、
、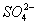
B.室温下,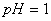 的盐酸中:
的盐酸中: 、
、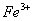 、
、 、
、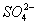
C.含有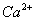 的溶液中:
的溶液中: 、
、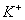 、
、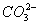 、
、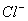
D.由水电离产生的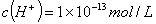 的溶液中:
的溶液中: 、
、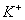 、
、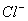 、
、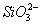
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素中按微粒半径递增顺序排列的是( )
A. K、Na、Li B.Ba2+、Ca2+、Mg2+ C. N、O、F D. Ca2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,可逆反应2X(g)+3Y(g) 4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
A.c1∶c2=2∶3 B.平衡时,Y和Z的生成速率之比为3∶4
C. X、Y的转化率相等 D. c3的取值范围为0<c3<0.28 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,既属于氧化还原反应,又是吸热反应的是
A.铝片与稀盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.酒精在空气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量为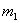 g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验设计1:镁铝合金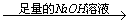 充分反应后测定剩余固体质量
充分反应后测定剩余固体质量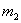 g
g
实验设计2:镁铝合金 生成的气体在标准状况下的体积为VL。
生成的气体在标准状况下的体积为VL。
请回答以下问题:
(1)实验设计1:
①在溶解、过滤中使用的玻璃仪器除烧杯外还有 。
②镁的质量分数: 。如果过滤得到沉淀没有用蒸馏水洗涤数次后烘干,再测定剩余固体质量。则镁的质量分数会 (填“偏大”、“偏小”或“无影响”)。
(2)实验设计2:测定生成的气体装置如右图,进行的操作有:
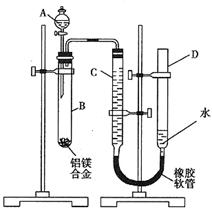 a.记录C的液面位置;
a.记录C的液面位置;
b.由A向B中滴加足量试剂。
c.待B中不再有气体产生并恢复至室温后,记录
C的液面位置;
d.检查气密性;
e. 将药品和水装入各仪器中,连接好;
①上述操作的顺序是:________________(填序号)。
②记录C的液面位置时,除视线平视外,还应注意:
_____________ 。

 (3)请你利用实验设计1和实验设计2的模式再设计一个实验方案测定其中镁的质量分数:
(3)请你利用实验设计1和实验设计2的模式再设计一个实验方案测定其中镁的质量分数:

 铝镁合金 溶液 过滤,测定质量。
铝镁合金 溶液 过滤,测定质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g)
ΔH=+140.5 kJ·mol-1
C(s,石墨)+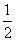 O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是 ( )。
A.+80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.-80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列相应要求的热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热)
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
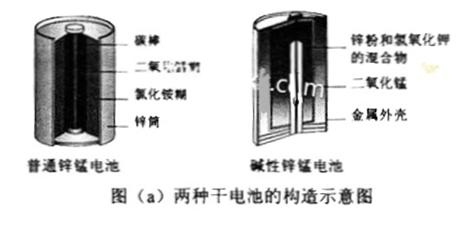
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
回答下列问题:
(1) 普通锌锰电池放电时发生的主要反应为:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
① 该电池中,负极材料主要是 ________,电解质的主要成分是______,正极发生的主要反应是_______
________,电解质的主要成分是______,正极发生的主要反应是_______ 
 。
。
② 与普通锌锰电池相比,碱性锌锰电池的优点及其理由是
_______ 。
(2)
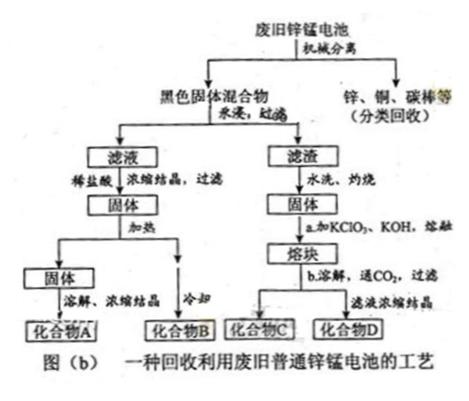 |
 废旧电池中实际存在的少量其他金属)。
废旧电池中实际存在的少量其他金属)。 (3)图(b)中产物的化学式分别为A_______,B________。
① 操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为
_______ 。
② 采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com