
【题目】下列物质间有如下转化关系,请按要求填空。
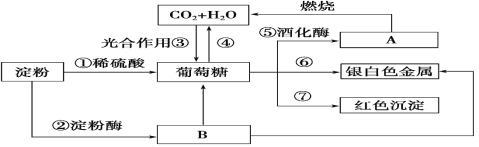
(1)在制镜工业和热水瓶胆镀银时,常利用上述反应________(填序号)。
(2)反应①②的反应类型为_______(填选项字母)。
A.氧化反应 B.加成反应 C.水解反应 D.消去反应
(3)反应⑦可用于检验糖尿病病人尿液中的含糖量,该反应的化学方程式为_________。
【答案】⑥ C CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH![]() CH2OH(CHOH)4COONa+Cu2O↓+3H2O
CH2OH(CHOH)4COONa+Cu2O↓+3H2O
【解析】
淀粉在稀硫酸作用下水解生成葡萄糖,还可以在淀粉酶的作用下,水解成麦芽糖、葡萄糖,B为麦芽糖、葡萄糖,葡萄糖在人体内最终转化为二氧化碳和水,水和二氧化碳通过植物的光合作用可以转化为葡萄糖,葡萄糖在酒化酶的作用下可生成乙醇,则A为乙醇,葡萄糖为多羟基醛,分子结构中含有醛基,醛基可使与氨溶液反应生成Ag单质,则⑥为银镜反应,可用于制镜工业和热水瓶胆镀银,在加热条件下,醛基还可与新制的氢氧化铜反应生成砖红色氧化亚铜沉淀,则⑦为葡萄糖与新制的氢氧化铜反应生成砖红色氧化亚铜沉淀,医疗上可用于检验糖尿病病人尿液中的含糖量。
(1)根据分析,在制镜工业和热水瓶胆镀银时,常利用上述反应⑥;
(2)根据分析,反应①②为淀粉的水解反应,答案选C;
(3)根据分析,反应⑦为葡萄糖与新制的氢氧化铜反应生成砖红色氧化亚铜沉淀,可用于检验糖尿病病人尿液中的含糖量,该反应的化学方程式为CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH![]() CH2OH(CHOH)4COONa+Cu2O↓+3H2O。
CH2OH(CHOH)4COONa+Cu2O↓+3H2O。


科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___Fe2++___ClO-+___=___Fe(OH)3↓+___C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___(填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)212H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___。
(2)实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___。
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂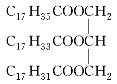 能发生的反应有( )
能发生的反应有( )
①皂化反应 ②使高锰酸钾酸性溶液褪色 ③使溴水褪色 ④氧化反应 ⑤还原反应 ⑥加成反应
A.①⑤B.①②③④
C.①④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下化学反应CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为:K=________________。
(2)写出一种加快该化学反应的反应速率的方法_____________________。
(3)该反应为_____________反应(填“吸热”或“放热”)。
(4)下列能说明该反应已达到化学平衡状态的是____________________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=2υ逆(H2O) d .c(CO2)=c(CO)
(5)某温度下,各物质的平衡浓度符合:c(CO2)c(H2)=c(CO)c(H2O),则该反应的反应温度为_______________________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
①含有大量![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
②![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
③水电离的![]() 浓度为
浓度为![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
④加入Mg能放出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
⑤![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
⑥![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
⑦使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
A.②⑥⑦B.①④⑤⑥C.②④⑥D.①③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C8H14O6,1mol该酯完全水解可得到2mol羧酸和1mol某常见的醇,且1mol该羧酸能与足量的钠反应放出22.4L(标准状况)H2,下列说法错误的是( )
A. 该醇是乙二醇B. 该羧酸有3种同分异构体
C. 该羧酸含有的官能团是羟基和羧基D. 该羧酸的分子式是C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。如图是硫元素的价类二维图,回答下列问题:

(1)图中已标明的物质中(不含X、Y),属于电解质的有______________种。
(2)X的化学式为________;标准状况下,______mol Y与3.36L SO2具有相同数目的氧原子。
(3)某同学欲选用如图的部分装置和药品探究SO2的性质。
A. 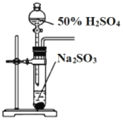 B. 溴水
B. 溴水 C.氢氧化钠溶液
C.氢氧化钠溶液  D. 石蕊溶液
D. 石蕊溶液 E. H2S溶液
E. H2S溶液
①为验证SO2具有氧化性和还原性,装置连接顺序为__________(用字母表示)。体现SO2具有还原性的反应方程式为______________。
②下列反应中,不属于SO2类别通性的是___________。
A.SO2 + H2OH2SO3
B.2SO2 + O2![]() 2SO3
2SO3
C.SO2 + 2NaOH = Na2SO3 + H2O
D.SO2 + CaO = CaSO3
(4)该同学设计如图装置进一步探究锌与浓硫酸反应除生成SO2外,是否还有氢气生成。(X为锌与浓硫酸共热时产生的气体)

①B中加入的试剂是___________;E的作用是_______。
②可以证明气体X中含有氢气的实验现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在![]() 时,
时,![]()
![]()
![]()
![]()
![]() 、
、![]() 、
、![]()
又已知:![]() ,下列说法正确的是
,下列说法正确的是![]()
A.醋酸钠水解的平衡常数![]() 随温度升高而减小
随温度升高而减小
B.![]() 醋酸钠溶液pH为m,其水解的程度
醋酸钠溶液pH为m,其水解的程度![]() 已水解的醋酸钠与原有醋酸钠的比值
已水解的醋酸钠与原有醋酸钠的比值![]() 为a;
为a;![]() 醋酸钠溶液pH为n,水解的程度为b,则
醋酸钠溶液pH为n,水解的程度为b,则![]() 、
、![]()
C.醋酸钠的水解的平衡常数![]()
D.在某溶液中含![]() 、
、![]() 、
、![]() 三种离子的浓度均为
三种离子的浓度均为![]() ,向其中加入固体醋酸钠,使其浓度为
,向其中加入固体醋酸钠,使其浓度为![]() ,以上三种金属离子中只有
,以上三种金属离子中只有![]() 能生成沉淀
能生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2 mol A和4 mol B混合发生下列反应:
A(g)+2B(g) ![]() 2C(g) ΔH<0。
2C(g) ΔH<0。
(1)当反应达到平衡时,A和B的浓度比是_______;A和B的转化率比是_______。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_________,密度_________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度______(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com