
【题目】下图为合成氨反应(N2+ 3H2![]() 2NH3 ΔH<0 )中氮气反应速率v(N2)变化的图象,则横坐标不可能的是
2NH3 ΔH<0 )中氮气反应速率v(N2)变化的图象,则横坐标不可能的是

A. 温度(T/K) B. 压强(P/Pa)
C. 反应时间(t/min) D. 氮气浓度(c/mol·L―1)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. H2分子中含σ键而N2分子中还含π键
B. π键是由两个p轨道“肩并肩”重叠形成的
C. 乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D. σ键一定是有s轨道参与形成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两位同学设计实验确定某酸HA是弱电解质,实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入 0.1 mol·L-1 的HA溶液、稀盐酸各10 mL,按图装好,观察现象。

乙:方案一:用pH计测定浓度为 0.1 mol·L-1HA溶液的pH;
方案二:取pH=3的HA溶液5 mL稀释至500 mL,再用pH计测其pH。
回答下列问题:
(1)甲同学设计的方案中,说明HA是弱电解质的实验现象是___________ (填序号)。
A. 加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B. 加入HA溶液后,试管上方的气球鼓起慢
C. 加入稀盐酸后,试管上方的气球鼓起慢
(2)乙同学设计的方案一中说明HA是弱电解质的理由是:测得 0.1 mol·L-1 的HA溶液的pH ______1(填“>”、“<”或“=”);
(3)乙同学设计的方案二能证明改变条件,弱电解质电离平衡发生移动。乙同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在 0.1mol·L-1 的HA溶液中,选择加入____________试剂;
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在 0.1mol·L-1 的HA溶液中,选择加入_____________试剂。
(4)若从水解原理角度设计一个合理而比较容易进行的方案(药品可任取) ,证明HA是弱电解质,你的设计方案是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2O
C. 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____________; lmol O22+中含有的π键数目为_______________。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为_________。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是___________________;分子中处于同一直线上的原子数目最多为_______________。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),则该晶胞中的碳原子个数为______。 CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2 晶体中1个Ca2+周围距离最近的C22-数目为_________________。
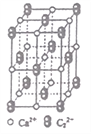
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是一种重要的有机化工原料,如图所示是以有机物X为原料设计的合成路线(部分产物、个别合成路线、反应条件等略去)。

己知:ⅰ.X为芳香烃,其相对分子质量为92;Y是一种功能高分子材料。
ⅱ.烷基苯在酸性高锰酸钾的作用下,侧链被氧化成羧基:![]() 。
。
ⅲ. ![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
请根据本题所给信息与所学知识回答下列问题:
(1)X结构简式为________________。![]() 中官能团的名称为______________。
中官能团的名称为______________。
(2)反应③的反应类型是__________;反应②和③的顺序不能交换的原因是_____________。
(3)已知A为一氯代物。
反应④的化学方程式为___________________________。
反应⑤的离子方程式为_________________________。
(4)阿司匹林有多种同分异构体,满足下列条件的同分异构体有___________ 种。
①芳香族化合物
②不能发生水解反应,也不能发生银镜反应;
③1mol该有机物最多能与2molNaHCO3完全反应。
(5)写出以A为原料制备![]() 的合成路线流程图(其它试剂任选)__________。合成路线流程图的示例如下:
的合成路线流程图(其它试剂任选)__________。合成路线流程图的示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化镁是重要的无机材料,在常温下易吸湿,可溶于水和乙醇。某兴趣小组以海水为原料制备无水氯化镁。
实验一 制备MgCl2·6H2O晶体
以海水为原料,对其进行一系列处理,得到晶体。
(1)除去海水中不溶性杂质常用的实验操作是______(填名称)。
(2)从氯化镁溶液中析出MgCl2·6H2O晶体的结晶方法是__________(填“降温结晶”或“蒸发结晶”)。
实验二 样品中MgCl2·6H2O晶体含量测定
准确称取实验一制得的MgCl2·6H2O晶体a g于锥形瓶中,加去离子水溶解,依次加入一定量三乙醇胺、NH3-NH4Cl缓冲溶液,摇匀,滴入铬黑T指示剂,用0.02000 mol·L-1EDTA(用H2Y2-表示)标准溶液滴定至终点,消耗EDTA溶液的体积VmL。
已知:①0.02000 mol·L-1EDTA标准溶液pH约为5,指示剂铬黑T使用的适宜pH范围为8~11,NH3-NH4Cl缓冲溶液pH约为10。
②滴定原理:Mg2++ H2Y2-= MgY2-+2H+。
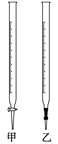
(3)使用的滴定管是____________________(填 “甲”或“乙”)。
(4)NH3-NH4Cl缓冲溶液的作用是_______________。
(5)样品中MgCl2·6H2O的质量分数为______________。
实验三 制备无水氯化镁
利用如图实验装置(夹持和加热装置省略),准确称取一定质量 MgCl2·6H2O晶体在HCl气流中小心加热。
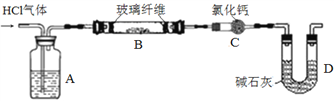
(6)A装置的作用是______________。
(7)某同学在实验前后测得玻璃管B减重m1g,干燥管C增重m2g,m1>m2,其可能的原因是______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体Na2SO3受热易分解,实验流程和结果如下:
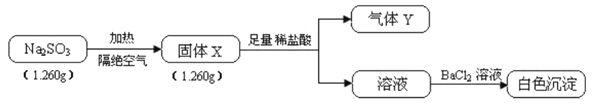
气体Y是一种纯净物,在标准状况下的密度为1.518g·L-1、请回答:
(1)气体Y分子的电子式___,白色沉淀的化学式_______。
(2)该流程中的Na2SO3受热分解的化学方程式__________。
(3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式____________(不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式或电极反应式书写正确的是( )
A. 用石墨作电极电解CuSO4溶液2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B. 碳酸钠溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D. 在强碱溶液中Fe(OH)3与NaClO反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com