
【题目】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____________; lmol O22+中含有的π键数目为_______________。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为_________。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是___________________;分子中处于同一直线上的原子数目最多为_______________。
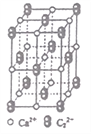
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),则该晶胞中的碳原子个数为______。 CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2 晶体中1个Ca2+周围距离最近的C22-数目为_________________。
【答案】 ![]() 2NA 1s22s22p63s23p63d10 sp杂化 sp2杂化 3 8 4
2NA 1s22s22p63s23p63d10 sp杂化 sp2杂化 3 8 4
【解析】(1)等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;(2)Cu为29号元素,得出Cu+的基态电子排布式为;(3)丙烯腈(H2C=CH-C≡N)中的C分别形成2个![]() 键和3个
键和3个![]() 键,故碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;(4)根据均摊法分析晶体结构。
键,故碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;(4)根据均摊法分析晶体结构。
(1)由C22-电子式为[∶CC∶]2-可推知O22+电子式为[∶OO∶]2+,氧氧三键中含两个π键,1 mol O22+中含有π键数目为2NA。
(2)Cu+由Cu原子失去1个电子而得到,故基态核外电子排布式为1s22s22p63s23p63d10。
(3)丙烯腈分子中碳碳双键为sp2杂化,—C≡N键为sp杂化,其分子中有一个三键,故共键的原子为C-C≡N即3个原子共线。因此,本题正确答案为:sp杂化 ;sp2杂化; 3
(4)由晶胞图知C22-位于面心和顶点,根据均摊法,晶胞中的碳原子个数为=2×(8×![]() +6×
+6×![]() )=8;由晶体结构可知CaC2晶体中1个Ca2+周围距离最近的C22-数目不是6个而是4个,因为哑铃形C22-只向一个方向拉长,此方向上的两个C22-与Ca2+距离不是最近,所以最近且等距的有4个。因此,本题正确答案为:8 ;4。
)=8;由晶体结构可知CaC2晶体中1个Ca2+周围距离最近的C22-数目不是6个而是4个,因为哑铃形C22-只向一个方向拉长,此方向上的两个C22-与Ca2+距离不是最近,所以最近且等距的有4个。因此,本题正确答案为:8 ;4。


科目:高中化学 来源: 题型:
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
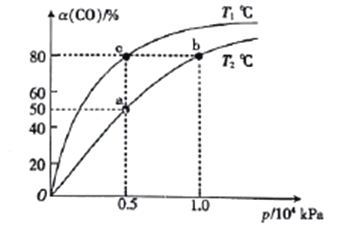
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在自然界中有很多存在形式,在地壳中主要以NaIO3 形式存在,在海水中主要以I-形式存在,几种粒子与Cl2之间有以下转化关系:
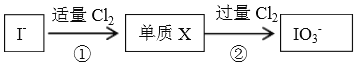
以下说法不正确的是
A. ①中发生的反应是:2I-+Cl2=I2+2Cl-
B. I-与过量Cl2发生的反应是:I-+3Cl2+3H2O=IO3-+6Cl-+6H+
C. 以上反应中,氯气都体现氧化性,具体表现为:氯元素由0价降低为-1价
D. 通过以上信息,可预测:若在加入淀粉的KI溶液中逐滴滴加氯水,不能观察到溶液变蓝的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。下列说法不正确的是

A. H2CO3、HCO3-、CO32-不能在同一溶液中大量共存
B. H2CO3电离平衡常数Ka1≈10-6
C. pH=7时,溶液中存在关系c(HCO![]() )>c(H2CO3)>c(CO
)>c(H2CO3)>c(CO![]() )
)
D. pH=9时,溶液中存在关系c(H+)+c(H2CO3)=c(OH-)+c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定意义重大,氮肥的大面积使用提高了粮食产量。
(1)目前人工固氮有效且有意义的方法是_______________(用一个化学方程式表示)。
(2)自然界发生的一个固氮反应是N2(B)+O2(g) ![]() 2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ·mol-1、498kJ·mol-1、632kJ·mol-1,则该反应的△H=____kJ·mol-1。
2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ·mol-1、498kJ·mol-1、632kJ·mol-1,则该反应的△H=____kJ·mol-1。
(3)恒压100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
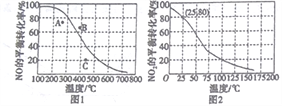
①图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则____________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则____________点对应的压强最大。
②恒压100kPa、25℃时,2NO2(g) ![]() N2O4(g)平衡体系中N2O4的物质的量分数为______________,列式计算平衡常数Kp=____________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中N2O4的物质的量分数为______________,列式计算平衡常数Kp=____________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)室温下,用往射器吸入一定量NO2气体,将针头插入胶塞密封,然后迅速将气体体积压缩为原来的一半并使活塞固定,此时手握针筒有热感,继续放置一段时间。从活塞固定时开始观察,气体颜色逐渐__________(填“变深”或“变浅”),原因是________________。[已知2NO2(g)![]() N2O4(g)在几微秒内即可达到化学平衡]
N2O4(g)在几微秒内即可达到化学平衡]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为合成氨反应(N2+ 3H2![]() 2NH3 ΔH<0 )中氮气反应速率v(N2)变化的图象,则横坐标不可能的是
2NH3 ΔH<0 )中氮气反应速率v(N2)变化的图象,则横坐标不可能的是

A. 温度(T/K) B. 压强(P/Pa)
C. 反应时间(t/min) D. 氮气浓度(c/mol·L―1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据下列有关规定的情景填空。
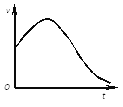
(1)①下图是除去氧化膜的镁条投入稀盐酸中产生氢气的速率随时间的变化关系,曲线前段出现高峰的主要影响因素是________。
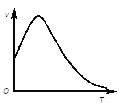
②下图是过氧化氢在酶的催化作用下分解速率随温度的变化关系,曲线后段明显下降的主要影响因素是__。
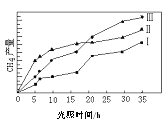
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图。在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为_________(填序号)。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图。
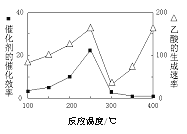
①250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________。
②当温度的取值范围在________时,温度是影响乙酸的生成速率的主要因素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取7.90gKMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+存在。
请计算:
(1)KMnO4的分解率_______________。
(2)气体A的物质的量_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品包装袋中有一个小纸袋,上面写着“石灰干燥剂”。
(1)“石灰干燥剂”的主要成分石灰是______________(填化学式),石灰所属的物质类型__________________(填序号)。
①金属氧化物 ②碱性氧化物 ③碱 ④碱性干燥剂 ⑤纯净物 ⑥化合物 ⑦盐
(2)生石灰可做干燥剂的理由是________________________(用化学方程式表示)。
(3)你认为下列内容还必须在这种小纸袋上注明的是____________(填序号)。
①禁止食用 ②可以食用 ③禁止未成年人用手拿 ④生产日期
(4)小纸袋中的物质能否长期地作干燥剂?为什么?_______________________________。
(5)某同学将浓硫酸、氢氧化钠固体、生石灰等物质划分为一类。该同学的分类依据为____________(填字母)。
A. 酸类 B. 碱类 C. 氧化物 D. 干燥剂
(6)生石灰还可以跟哪些类别的物质发生化学反应?请列举三例并填表。__________________、__________________、__________________、__________________、__________________、__________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com