
����Ŀ������������йع涨���龰��ա�
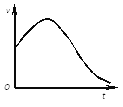
��1������ͼ�dz�ȥ����Ĥ��þ��Ͷ��ϡ�����в���������������ʱ��ı仯��ϵ������ǰ�γ��ָ߷����ҪӰ��������________��
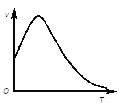
����ͼ�ǹ���������ø�Ĵ������·ֽ��������¶ȵı仯��ϵ�����ߺ�������½�����ҪӰ��������__��
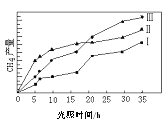
��2�����ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2�����������ʱ���ڲ�ͬ������I��II��III�������£�CH4���������ʱ��ı仯��ͼ����0��15Сʱ�ڣ�CH4��ƽ����������I��II��III�Ӵ�С��˳��Ϊ_________������ţ���
��3����TiO2��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ��
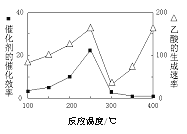
��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����_____________��
�ڵ��¶ȵ�ȡֵ��Χ��________ʱ���¶���Ӱ��������������ʵ���Ҫ���ء�
���𰸡��¶� Ũ�� II��III��I �¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��� 300�桫400��
��������
���ͼ��۲����ʵı仯����Ӱ�����ʵ�������ط������
��1���ٸ���Ӱ�����ʵ����ط���������ԭ���Ƿ�Ӧ���ȣ��¶����ߵ������ʼӿ죬
�ʴ�Ϊ���¶ȣ�
�����ŷ�Ӧ���У���Ӧ��Ũ�Ƚ��ͣ����Է�Ӧ���ʼ�����
�ʴ�Ϊ��Ũ�ȣ�
��2�����ʿ����õ�λʱ���ڼ���IJ�������������ͼ����Կ�������0��15Сʱ�ڣ�CH4��ƽ����������I��II��III�Ӵ�С��˳��Ϊ��II��III��I��
�ʴ�Ϊ��II��III��I��
��3������֪�����Է�Ӧ��������Ҫ��ģ���250��300��ʱ���¶����߶�������������ʽ��͵�ԭ���ǣ��¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ�
��������������֪���¶ȹ���ʱ��������Ч�ʽ��ͣ���ͼ���֪300���Ժ����������¶������ֿ�ʼ���ߣ����Ե��¶ȵ�ȡֵ��Χ��300�桫400��ʱ���¶���Ӱ��������������ʵ���Ҫ���ء�
�ʴ�Ϊ���¶ȳ���250��ʱ�������Ĵ�Ч�ʽ����� 300�桫400�棻


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС���ͬѧ�Ժ�������Na2SO4��NaOH��Ʒ��NaOH�ĺ������вⶨ���ش���������:
��1����ͬѧ���ó������ⶨ��Ʒ��NaOH�ĺ�������ͬѧѡ�õ�ҩƷ����Ʒ������ˮ��MgCl2��Һ����Ҫ�ⶨ��ʵ��������__________��
��2����ͬѧ�����к͵ζ����ⶨ��Ʒ��NaOH�ĺ�����
���÷�����ƽȷ��ȡ����Ʒ5.0000 g��ȫ������ˮ���Ƴ�1000.0 mL��Һ���ü�ʽ�ζ�����ȡ20.00 mL������Һ������ƿ�У��μӼ���ָʾ�������⡣�ζ�����ʹ��ǰ��ϴ���⣬��Ӧ____________________________________��
����Ũ��Ϊ0.100 0 mol��L��1���������Һ���еζ�����ʼ�ζ�ǰ��һ��������________��
�۵ζ���������pH�Ʋⶨ��ƿ����Һ��pH���ٽ��ζ��յ�ʱ�ⶨpHӦÿ��һ�β�һ�Ρ�
�ܵζ������У���ƿ����Һ��pH�仯���£�
V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
��������ͼ�л��Ƴ������к͵ζ������ߡ�______________

�������ʾ�Ǽ������ָʾ���ı�ɫ��Χ���������������к͵ζ����߷����������к͵ζ���Ӧѡ�õ�ָʾ����________��
ָʾ�� | ��ɫ��Χ(pH) | ��ɫ | |
�� | �� | ||
���� | 3.1��4.4 | �� | �� |
ʯ�� | 5.0��8.0 | �� | �� |
��̪ | 8.2��10.0 | �� | �� |
����Ʒ�У�NaOH�������ٷֺ���Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA������˵����ȷ����
A. ��״���£�2.24LCH3OH�����й��ۼ�����ĿΪ0.5NA
B. 1molNa2O2������CO2��ַ�Ӧ��ת�Ƶĵ�����Ϊ2 NA
C. 25��1LpH=12��Na2CO3��Һ�У���ˮ�����H+����ĿΪ0.01NA
D. 0.1molH2��0.1molI2���ܱ������г�ַ�Ӧ��HI��������Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ���л��ϳɹ�ҵ��һ��ԭ�ϡ���ҵ������CaC2��ˮ��Ӧ������Ȳ��
(1)CaC2��C22-��O22+��Ϊ�ȵ����壬O22+�ĵ���ʽ�ɱ�ʾΪ_____________�� lmol O22+�к��еĦм���ĿΪ_______________��
(2)����Ȳͨ��[Cu(NH3)2]Cl��Һ����Cu2C2����ɫ������Cu+��̬��������Ų�ʽΪ_________��
(3)��Ȳ�������ᷴӦ�ɵñ�ϩ��(H2C=CH-C��N)����ϩ�������̼ԭ�ӹ���ӻ�������___________________�������д���ͬһֱ���ϵ�ԭ����Ŀ���Ϊ_______________��
(4)CaC2����ľ����ṹ��NaCl���������(��ͼ��ʾ)����þ����е�̼ԭ�Ӹ���Ϊ______�� CaC2�����к��е���������C22-�Ĵ��ڣ�ʹ������һ������������CaC2 ������1��Ca2+��Χ���������C22-��ĿΪ_________________��
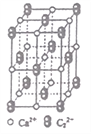
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ͼ��ʾ����֪�л���A����Է���������28�����IJ����Ǻ���һ������ʯ�ͻ���ˮƽ�ı�־��B��D�����ճ�����ʳƷ�г������л��E�Ǿ���Ũ����ζ����������ˮ����״Һ�壬F��һ�ָ߾����������������ʳ�ﱣ��Ĥ��
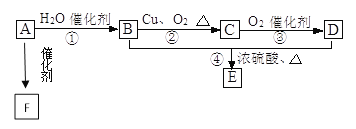
��1����д��A�Ľṹ��ʽ________��C�Ľṹʽ__________��
��2����д��B�й����ŵĵ���ʽ__________��D�й����ŵ�����__________��
��3����д�����з�Ӧ�����ͣ���__________����________����__________��
��4����д����������ת���Ļ�ѧ����ʽ��A��F ____________�� B��C _______��B+D��E __________��
��.��ʵ���ҿ�������ͼ��ʾ��װ�ý���B��D�ķ�Ӧ����ش��������⣺
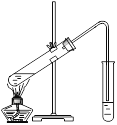
��1��װ����ͨ�����ĵ���Ҫ����_______��Һ��Һ���Ϸ��������ܲ�����Һ�е�ԭ����Ϊ��________������Һ��������____________________________________��
��2����Ҫ���Ƶõ������������������Ӧ���õ�ʵ�������______��
��. ƻ������һ����ƻ�����Ͷ��ɵ�������Ʒ�����нⶾ����֬��ҩЧ��ƻ������ƻ������Ҫ�ɷ֣���ṹ��ʽ��ͼ��ʾ����ش��������⣺
![]()
��1��ƻ����ķ���ʽΪ__________��
��2��1 molƻ���������������Ʒ�Ӧ�������ɱ�״���µ�����____L��
��3����һ�������£�ƻ���������������Щ���ʷ�����Ӧ��_________
A������������Һ B������ C��̼��������Һ D���Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�þ����Ҫ�������ϣ��ڳ���������ʪ��������ˮ���Ҵ���ij��ȤС���Ժ�ˮΪԭ���Ʊ���ˮ�Ȼ�þ��
ʵ��һ �Ʊ�MgCl2��6H2O����
�Ժ�ˮΪԭ�ϣ��������һϵ�д������õ����塣
��1����ȥ��ˮ�в��������ʳ��õ�ʵ�������______�������ƣ���
��2�����Ȼ�þ��Һ������MgCl2��6H2O����Ľᾧ������__________������½ᾧ���������ᾧ������
ʵ��� ��Ʒ��MgCl2��6H2O���庬���ⶨ
ȷ��ȡʵ��һ�Ƶõ�MgCl2��6H2O����a g����ƿ�У���ȥ����ˮ�ܽ⣬���μ���һ�������Ҵ�����NH3��NH4Cl������Һ��ҡ�ȣ��������Tָʾ������0.02000 mol��L��1EDTA����H2Y2����ʾ������Һ�ζ����յ㣬����EDTA��Һ�����VmL��
��֪����0.02000 mol��L��1EDTA����ҺpHԼΪ5��ָʾ������Tʹ�õ�����pH��ΧΪ8��11��NH3��NH4Cl������ҺpHԼΪ10��
�ڵζ�ԭ����Mg2++ H2Y2���� MgY2��+2H+��
��3��ʹ�õĵζ�����____________________���� ���ס����ҡ�����
��4��NH3��NH4Cl������Һ��������_______________��
��5����Ʒ��MgCl2��6H2O����������Ϊ______________��
ʵ���� �Ʊ���ˮ�Ȼ�þ
������ͼʵ��װ�ã��гֺͼ���װ��ʡ�ԣ���ȷ��ȡһ������ MgCl2��6H2O������HCl������С�ļ��ȡ�
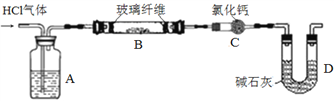
��6��Aװ�õ�������______________��
��7��ijͬѧ��ʵ��ǰ���ò�����B����m1g�������C����m2g��m1��m2������ܵ�ԭ����______________���û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AlN)��һ�����������ϣ��㷺Ӧ���ڼ��ɵ�·���մɵ���������ҵ�����������뽹̿�ڵ������и����Ƶ�:Al2O3+3C+N2![]() 2AlN+3CO����ش�:
2AlN+3CO����ش�:
(1)������Ӧ���������뻹ԭ�������ʵ���֮��___________________��
(2)�Ƶõĵ�������Ʒ�г�����Al4C3��Al2O3��C�����ʣ���֪:
ϡ����(����) | ŨNaOH��Һ(����) | |
AlN | 2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4 | AlN+NaOH+H2O=NaAlO2+NH3 �� |
Al4C3 | Al4C3+6H2SO4=2Al2(SO4)3+3CH4 �� | Al4C3+4NaOH+4H2O=4NaAlO2+3CH4 �� |
Ϊ�ⶨ��Ʒ��AlN��Al4C3�ĺ������������������ʵ��װ��(��ͨ������У����ʵ��ȣ����Կ�����ˮ������CO2��Ӱ�켰NH3��ǿ������Һ�е��ܽ�)��

װ��I��II�ڷ�Ӧǰ���������ֱ�Ϊm1 g��m2 g����m g��Ʒ��AlN����������Ϊ______(�ú�m��m1��m2�Ĵ���ʽ��ʾ)��
(3)ȡװ��I�з�Ӧ�����Һ���ȼ�������(NH4)2SO4��Һ��Ȼ�����ν�������Ũ������ȴ�ᾧ�����ˡ��������ƾ�ϴ�ӡ���ֽ���ɣ��õ����������[NH4Al(SO4)2��12H2O]��
������Ũ������ʱ����������̨(����Ȧ)���ƾ��ơ�����ǯ���������⣬����Ҫ_______(����������)������Ũ���IJ�����С����ȣ����Ͻ��裬_________��
���������ƾ�ϴ�ӵ�Ŀ��__________________________��
(4)��֪:25��ʱ��Kw=1.0��10-14��Kb(NH3��H2O)=1.8��10-5��Kb(Al(OH)3]=1.4��10-9��
�� NH4Al(SO4)2��Һ������Ũ���ɴ�С��˳��_________________��
��(NH4)2SO4��Һ�д���ˮ��ƽ�⣬��ˮ��ƽ�ⳣ��Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڴ��������£����Ҵ�����ϩ���Ҵ�ת���ʺ���ϩѡ����(������ϩ�����ʵ������Ҵ�ת�������ʵ����ı�ֵ)���¶ȡ���ϩ������(��λ�� ![]() )�Ĺ�ϵ��ͼ��ʾ(��������������ͬ)��
)�Ĺ�ϵ��ͼ��ʾ(��������������ͬ)��
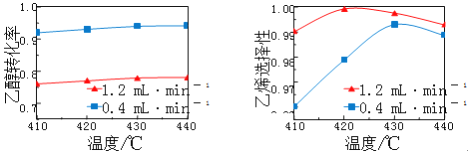
��410~440���¶ȷ�Χ�ڣ�����˵������ȷ����
A. ���Ҵ�������һ�������Ҵ�ת����������ϩѡ��������
B. ���Ҵ�������һ�������¶ȵ����ߣ���ϩѡ���Բ�һ������
C. ���¶�һ�������Ҵ������������Ҵ�ת���ʼ�С
D. ���¶�һ�������Ҵ�������������ϩѡ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��һ����Ҫ�Ļ���ԭ������֪A�ڱ�״���µ��ܶ�Ϊ1.25 g��L��1��B�ɷ���������Ӧ������֮���ת����ϵ��ͼ��
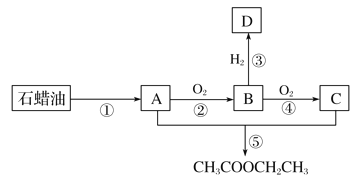
��ش���
(1)�л���B�к��еĹ�����������_______________________________________________��
(2)�����������ӳɷ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽ��_________________________________��
(3)�����������л���D��Ӧ���õ�������������ˮ���μ�2�η�̪��Һ��ˮ��Һ�Ժ�ɫ����ԭ����__________________(�û�ѧ����ʽ��ʾ)��
(4)����˵����ȷ����________��
A���л���A��D��һ�������¿ɷ�Ӧ��������[(CH3CH2)2O]
B�������Ƽ���������ͭ����Һ�������л���B��C��D
C��ͨ��ֱ�����������������л���C�Ļ�������ɷ���õ�������������
D����ͬ��������������������������Һ��ˮ�����ϡ�����и���ȫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com