
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路、陶瓷等生产领域。工业上由氧化铝与焦炭在氮气流中高温制得:Al2O3+3C+N2![]() 2AlN+3CO。请回答:
2AlN+3CO。请回答:
(1)上述反应中氧化剂与还原剂的物质的量之比___________________。
(2)制得的氮化铝产品中常含有Al4C3、Al2O3和C等杂质,已知:
稀硫酸(过量) | 浓NaOH溶液(过量) | |
AlN | 2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4 | AlN+NaOH+H2O=NaAlO2+NH3 ↑ |
Al4C3 | Al4C3+6H2SO4=2Al2(SO4)3+3CH4 ↑ | Al4C3+4NaOH+4H2O=4NaAlO2+3CH4 ↑ |
为测定产品中AlN和Al4C3的含量,设计了如下两套实验装置(在通风橱进行,可适当微热,忽略空气中水蒸气、CO2的影响及NH3在强碱性溶液中的溶解)。

装置I、II在反应前后的质量差分别为m1 g和m2 g,则m g产品中AlN的质量分数为______(用含m、m1、m2的代数式表示)。
(3)取装置I中反应后的滤液,先加入少量(NH4)2SO4溶液,然后依次进行蒸发浓缩、冷却结晶、过滤、用少量酒精洗涤、滤纸吸干,得到铵明矾晶体[NH4Al(SO4)2·12H2O]。
①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要_______(填仪器名称);蒸发浓缩的操作;小火加热,不断搅拌,_________。
②用少量酒精洗涤的目的__________________________。
(4)已知:25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9。
① NH4Al(SO4)2溶液中离子浓度由大到小的顺序_________________。
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数为_____________。
【答案】 1:3 [41(m2-m1)/17m]× 100% 蒸发皿 当液面上出现晶膜时停止加热 洗去晶体表面附着的水分 c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-) 5.6×10-10
【解析】(1)根据反应Al2O3+N2+3C![]() 2AlN+3CO,反应中氮元素化合价从0价变化为-3价,做氧化剂,被还原为AlN,碳元素化合价从0价变化为+2价,做还原剂,被氧化为一氧化碳,所以氧化剂与还原剂的物质的量之比为1:3;故答案为:1:3;
2AlN+3CO,反应中氮元素化合价从0价变化为-3价,做氧化剂,被还原为AlN,碳元素化合价从0价变化为+2价,做还原剂,被氧化为一氧化碳,所以氧化剂与还原剂的物质的量之比为1:3;故答案为:1:3;
(2)根据发生的反应:装置I中发生2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4、Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑,则生成甲烷的质量为m1g,装置II中发生AlN+NaOH+H2O=NaAlO2+NH3↑、Al4C3+4NaOH+4H2O=4NaAlO2+3CH4↑,生成的甲烷和氨气的质量之和为m2 g,则生成氨气的质量为(m2- m1)g,因此AlN的质量为![]() ×41g/mol=
×41g/mol=![]() g,因此mg产品中AlN的质量分数为
g,因此mg产品中AlN的质量分数为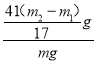 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%;
×100%;
(3) ①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要蒸发皿;蒸发浓缩的操作;小火加热,不断搅拌,当液面上出现晶膜时,停止加热,故答案为:蒸发皿;当液面上出现晶膜时,停止加热;
②用少量酒精洗涤,可以洗去晶体表面附着的水分,同时可以减少铵明矾晶体的损失,故答案为:洗去晶体表面附着的水分;
(4)①根据Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9可知,碱性NH3·H2O >Al(OH)3,则NH4Al(SO4)2溶液中Al3+水解程度大于NH4+,溶液显酸性,离子浓度由大到小的顺序为c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-),故答案为:c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-);
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数K=![]() =
=![]() =5.6×10-10,故答案为:5.6×10-10。
=5.6×10-10,故答案为:5.6×10-10。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
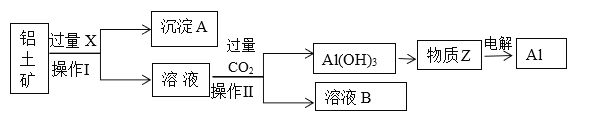
已知:2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。
(1)操作Ⅱ的名称___________,用到的玻璃仪器有_______________。
(2)X是___________,操作Ⅱ通入过量CO2的离子方程式:______________________________________。
(3)沉淀A的主要成分是________,在生活中有什么应用:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定意义重大,氮肥的大面积使用提高了粮食产量。
(1)目前人工固氮有效且有意义的方法是_______________(用一个化学方程式表示)。
(2)自然界发生的一个固氮反应是N2(B)+O2(g) ![]() 2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ·mol-1、498kJ·mol-1、632kJ·mol-1,则该反应的△H=____kJ·mol-1。
2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ·mol-1、498kJ·mol-1、632kJ·mol-1,则该反应的△H=____kJ·mol-1。
(3)恒压100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
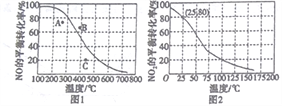
①图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则____________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则____________点对应的压强最大。
②恒压100kPa、25℃时,2NO2(g) ![]() N2O4(g)平衡体系中N2O4的物质的量分数为______________,列式计算平衡常数Kp=____________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中N2O4的物质的量分数为______________,列式计算平衡常数Kp=____________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)室温下,用往射器吸入一定量NO2气体,将针头插入胶塞密封,然后迅速将气体体积压缩为原来的一半并使活塞固定,此时手握针筒有热感,继续放置一段时间。从活塞固定时开始观察,气体颜色逐渐__________(填“变深”或“变浅”),原因是________________。[已知2NO2(g)![]() N2O4(g)在几微秒内即可达到化学平衡]
N2O4(g)在几微秒内即可达到化学平衡]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据下列有关规定的情景填空。
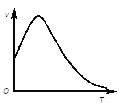
(1)①下图是除去氧化膜的镁条投入稀盐酸中产生氢气的速率随时间的变化关系,曲线前段出现高峰的主要影响因素是________。
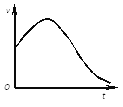
②下图是过氧化氢在酶的催化作用下分解速率随温度的变化关系,曲线后段明显下降的主要影响因素是__。
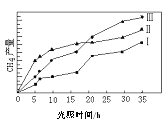
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图。在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为_________(填序号)。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图。
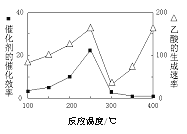
①250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________。
②当温度的取值范围在________时,温度是影响乙酸的生成速率的主要因素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:


查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如右图是所示。
(1)右图中的线2表示的组分为 (填化学式)。
(2)实验时,“反应II”中加入NaOH溶液的目的是 (用化学方程式表示)。
(3)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了两种方法进行测定。
①方法I:称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00mL。通过计算确定产品中Na2SO3的质量分数(写出计算过程)
③判断Na2SO3产品的等级,并说明理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取7.90gKMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+存在。
请计算:
(1)KMnO4的分解率_______________。
(2)气体A的物质的量_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现图示变化的是
物质编号 | 物质转化关系 | a | b | c | d |
① |
| NO | NO2 | N2 | HNO3 |
② | Na2O | Na2O2 | Na | NaOH | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. ①②③ B. ③④
C. ①③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列曲线中,纵坐标表示生成Al(OH)3的质量,横坐标表示加入试剂的体积。下列叙述中不正确的是( )
A. 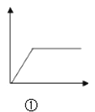 图①可表示向NH3·H2O中滴加AlCl3溶液至过量
图①可表示向NH3·H2O中滴加AlCl3溶液至过量
B. 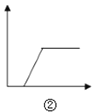 图②可表示向NaOH与NaAlO2的混合溶液中通入CO2至过量
图②可表示向NaOH与NaAlO2的混合溶液中通入CO2至过量
C. 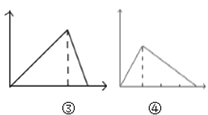 图③可表示向NaOH与NaAlO2的混合液中滴加HCl溶液至过量;而图④可表示向盐酸酸化的AlCl3溶液中滴加NaOH至过量
图③可表示向NaOH与NaAlO2的混合液中滴加HCl溶液至过量;而图④可表示向盐酸酸化的AlCl3溶液中滴加NaOH至过量
D.  图⑤可表示向MgCl2和AlCl3的混合液中滴加NaOH溶液至过量
图⑤可表示向MgCl2和AlCl3的混合液中滴加NaOH溶液至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
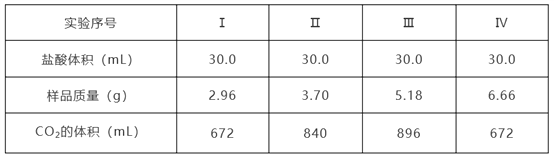
(1)样品中物质的量之比n(Na2CO3):n(NaHCO3)=_________。
(2)盐酸的物质的量浓度c(HCl)=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com