
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
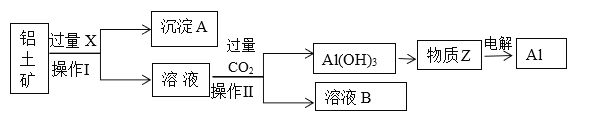
已知:2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。
(1)操作Ⅱ的名称___________,用到的玻璃仪器有_______________。
(2)X是___________,操作Ⅱ通入过量CO2的离子方程式:______________________________________。
(3)沉淀A的主要成分是________,在生活中有什么应用:________________________。
【答案】过滤 漏斗 烧杯 玻璃棒 NaOH溶液 AlO2- +CO2+2H2O=Al(OH)3↓+HCO3- Fe2O3 作红色油漆和涂料
【解析】
由于后续的溶液中通入二氧化碳生成氢氧化铝,说明溶液中含有偏铝酸根离子,则X是氢氧化钠,结合流程图以及物质的转化关系图分析解答。
由于后续的溶液中通入二氧化碳生成氢氧化铝,说明溶液中含有偏铝酸根离子,则X是氢氧化钠,氧化铝溶解在氢氧化钠中生成偏铝酸钠和水,氧化铁不溶,A是氧化铁。偏铝酸钠和足量二氧化碳反应生成碳酸氢钠和氢氧化铝沉淀,氢氧化铝受热分解生成氧化铝,电解熔融的氧化铝得到金属铝。则
(1)操作Ⅱ是得到分离出氢氧化铝沉淀,因此其操作的名称过滤,用到的玻璃仪器有漏斗、烧杯、玻璃棒;
(2)根据以上分析可知X是NaOH溶液,操作Ⅱ通入过量CO2的离子方程式为AlO2- +CO2+2H2O=Al(OH)3↓+HCO3-;
(3)根据以上分析可知沉淀A的主要成分是Fe2O3,在生活中的主要用途是作红色油漆和涂料。


科目:高中化学 来源: 题型:
【题目】硫酸是当今世界最重要的化工产品之一。
I.硫酸的各种制法。
(1)早在1000多年前,我国就已采用加热胆矾(CuSO4· 5H2O)或绿矾(FeSO4·7H2O)的方法制取硫酸。FeSO4受热分解的化学方程式:2 FeSO4![]() Fe2O3+SO2↑ +SO3↑。
Fe2O3+SO2↑ +SO3↑。
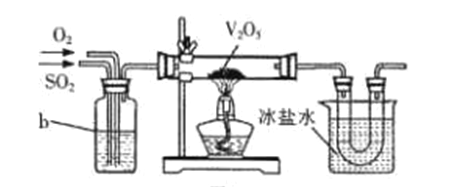
① 将FeSO4受热产生的气体通入如下图装置中,以检验产生的气体中是否含有SO3和SO2。 能说明SO2存在的实验现象是_________。

② 有同学提出虚线框内盛装NaOH溶液的装置可以换成上图右边的a装置,其中多孔玻璃球泡的作用是__________。
(2)目前工业上主要采用接触法制备硫酸,其中一步为:2SO2+O2![]() 2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
Ⅱ.硫酸的性质。
(3)下图中甲试管内发生反应的化学方程式_________ ,该反应体现了浓硫酸的性质为______。
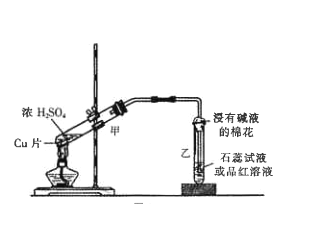
(4)当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到白色固体,请写出检验白色固体的方法______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
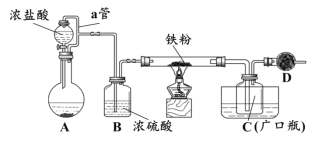
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学对含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量。该同学选用的药品有样品、蒸馏水、MgCl2溶液,需要测定的实验数据有__________。
(2)乙同学运用中和滴定法测定样品中NaOH的含量。
①用分析天平准确称取该样品5.0000 g,全部溶于水配制成1000.0 mL溶液。用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在使用前除洗涤外,还应____________________________________。
②用浓度为0.100 0 mol·L-1的盐酸标准溶液进行滴定。开始滴定前的一步操作是________。
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次。
④滴定过程中,锥形瓶中溶液的pH变化如下:
V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
请在坐标图中绘制出上述中和滴定的曲线。______________

⑤如表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是________。
指示剂 | 变色范围(pH) | 颜色 | |
酸 | 碱 | ||
甲基橙 | 3.1~4.4 | 红 | 黄 |
石蕊 | 5.0~8.0 | 红 | 蓝 |
酚酞 | 8.2~10.0 | 无 | 红 |
⑥样品中,NaOH的质量百分含量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g)△H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g)△H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g)△H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的![]() 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。
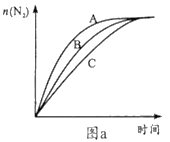
(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。
(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出了“积极参与全球环境治理,落实减排承诺”。其中氮的化合物的处理和利用是环境科学研究的热点。
(1)机动车排放的尾气中主要污染物为NOx ,可用 CH4 催化还原 NOx 以消除其污染。298 K时,1.0 g CH4 (g)与足量的NO气体完全反应生成N2、CO2和H2O(g),放出72. 5 kJ的热量。该反应的热化学方程式为_______________。
(2)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
ΔH1、ΔH2、ΔH3之间的关系为ΔH3=___________;K1、K2、K3的关系为K3=____________。
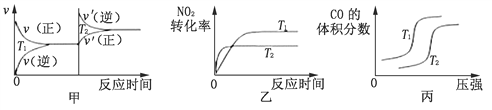
(3)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、NO2等有毒气体转化为无毒气体:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图像正确的是________(填序号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图像正确的是________(填序号)。
(4)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s) +2NO(g)![]() N2(g) + CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g) + CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
① T1℃时,该反应在0~20min的平均反应速率v(CO2)=__________________;该反应的平衡常数K= _____________;
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______(填序号);
A. 加入一定量的活性炭 B. 恒温恒压充入氩气
C. 适当缩小容器的体积 D. 加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则和原平衡相比,NO的转化率_____________(填“升高”或“降低”),ΔH_______0(填“﹥”、“﹤”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路、陶瓷等生产领域。工业上由氧化铝与焦炭在氮气流中高温制得:Al2O3+3C+N2![]() 2AlN+3CO。请回答:
2AlN+3CO。请回答:
(1)上述反应中氧化剂与还原剂的物质的量之比___________________。
(2)制得的氮化铝产品中常含有Al4C3、Al2O3和C等杂质,已知:
稀硫酸(过量) | 浓NaOH溶液(过量) | |
AlN | 2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4 | AlN+NaOH+H2O=NaAlO2+NH3 ↑ |
Al4C3 | Al4C3+6H2SO4=2Al2(SO4)3+3CH4 ↑ | Al4C3+4NaOH+4H2O=4NaAlO2+3CH4 ↑ |
为测定产品中AlN和Al4C3的含量,设计了如下两套实验装置(在通风橱进行,可适当微热,忽略空气中水蒸气、CO2的影响及NH3在强碱性溶液中的溶解)。

装置I、II在反应前后的质量差分别为m1 g和m2 g,则m g产品中AlN的质量分数为______(用含m、m1、m2的代数式表示)。
(3)取装置I中反应后的滤液,先加入少量(NH4)2SO4溶液,然后依次进行蒸发浓缩、冷却结晶、过滤、用少量酒精洗涤、滤纸吸干,得到铵明矾晶体[NH4Al(SO4)2·12H2O]。
①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要_______(填仪器名称);蒸发浓缩的操作;小火加热,不断搅拌,_________。
②用少量酒精洗涤的目的__________________________。
(4)已知:25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9。
① NH4Al(SO4)2溶液中离子浓度由大到小的顺序_________________。
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com