
����Ŀ���о�NO2��NO��CO��Ⱦ�ﴦ�����Խ��������й�������Ҫ���塣
��1����NO2(g)+CO(g)==CO2(g)+NO(g)��H1=-234.00kJ/mol
��1/2N2(g)+1/2O2(g)=NO(g)��H2=-89.75kJ/mol
��2NO(g)+O2(g)==2NO2(g)��H3=-112.30kJ/mol��
��NO2�����CO���巴Ӧ��������Ⱦ���������Ȼ�ѧ����ʽΪ______________��
��2��ij�¶��£���10L�ܱ������зֱ����0.1molNO2��0.2molCO��������Ӧ��2NO2(g)+4CO(g)=N2(g)+4CO2(g)����10min��Ӧ�ﵽƽ����������ѹǿ��Ϊԭ����![]() ��
��
��0��10min����CO��ƽ����Ӧ����v(CO)=__________��
���������й۲쵽_____�����жϸ÷�Ӧ�ﵽƽ��״̬��
��Ϊ������Ⱦ�ﴦ��Ч�ʣ���ʼ���Ͷ�ϱ�Ϊ______��
��ƽ�����CO��CO2����Ũ�ȷֱ�����һ������ƽ��_____(���������������������������ƶ���)��
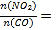
��3���ڸ�Ч������������NH3��ԭNO2������Ⱦ�ﴦ����
����ͬ�����£�ѡ��A��B��C���ִ������з�Ӧ�����ɵ��������ʵ�����ʱ��仯��ͼa�������С����______(��E(A)��E(B)��E(C)��ʾ���ִ����¸÷�Ӧ���)��
���ڴ���A�����²����ͬʱ�䴦��NO2�������¶ȹ�ϵ��ͼb����˵��ͼ��������������С��ԭ��________(������¶ȷ�Χ�ڴ�Ч����ͬ)��
��4�����������ں���NO2��������ˮ�м�����������۵Ķ����̿��������ˮ�ľ������Խ�ϵ缫��Ӧ˵�������̿����Ҫ����_____��
���𰸡� 2NO2(g)+4CO(g)=4CO2(g)+N2(g) ��H=-868.8kJ/mol 4��10-4mol/(L.min) ��ϵ��������ɫ���ٸı� ![]() ���ƶ� E(A) ����300�棬��Ӧδ�ﵽƽ�⣬�¶���������Ӧ���ʼӿ�������300�棬��Ӧ��ƽ�������¶���������Ӧ������� ����̿���������γɵ�ԭ�������������������Ӧ2NO2+8H++8e-=N2��+4H2O����NO2ת��Ϊ����Ⱦ����N2
���ƶ� E(A) ����300�棬��Ӧδ�ﵽƽ�⣬�¶���������Ӧ���ʼӿ�������300�棬��Ӧ��ƽ�������¶���������Ӧ������� ����̿���������γɵ�ԭ�������������������Ӧ2NO2+8H++8e-=N2��+4H2O����NO2ת��Ϊ����Ⱦ����N2
����������1����Ӧ�١�4���ڡ�2���ۡ�1�õ���2NO2(g)+4CO(g)=4CO2(g)+N2(g) ��H=-868.8kJ/mol��
��2�� 2NO2(g) + 4CO(g) = N2(g) + 4CO2(g)
��ʼ�� 0.1 0.2 0 0
��Ӧ�� x 2x x/2 2x
ƽ���� 0.1��x 0.2��2x x/2 2x
���º���ѹǿ�ıȵ�����������ʵ����ıȣ�����![]() �����x=0.02mol��
�����x=0.02mol��
�����ϲμӷ�Ӧ��COΪ0.04mol����Ӧ����Ϊ![]() = 4��10-4mol/(L.min)��
= 4��10-4mol/(L.min)��
�ڷ�Ӧ��ƽ���Ժ��������ʵ�Ũ�ȶ����仯����ΪNO2��Ũ�Ȳ��䣬������ϵ����ɫӦ��Ҳ���仯����۲쵽��ɫ���䣬֤����Ӧ��ƽ�⡣
��Ϊ������Ⱦ�ﴦ��Ч�ʣ�Ӧ�ñ�֤��Ӧ����ת��Ϊ�������������Ӧ�ﶼ��������������ʼ���Ͷ�ϱ�Ϊ![]() ��
��
�ܴ�ƽ��ʱһ����Q=K�����ڽ���CO��CO2����Ũ�ȷֱ�����һ������Ϊ���ߵ�ϵ����ȣ���һ���ڷ���һ���ڷ�ĸ������Ũ���̵ı�ֵQ���䣬��Q��Ȼ����K����Ӧƽ�ⲻ�ƶ���
��3����һ����˵����Ӧ�Ļ��ԽС����Ӧ������Խ�죬����E(A)��С��
������Ϊ�ڴ���A�����²����ͬʱ�䴦��NO2�������¶ȹ�ϵ���������ϵĵ㲻һ������ƽ��̬����Ӧ��������ʱ��ʱ��β��ܴ�ƽ�⣬������Խ�죬��Ӧ����Խ�ࣻ��Ӧ���ʺܿ��ʱ��Ӧ��ƽ�⣬���¶�Խ�ߣ�ƽ�������ƶ�����Ӧ�������١�����ԭ��Ϊ������300�棬��Ӧδ�ﵽƽ�⣬�¶���������Ӧ���ʼӿ�������300�棬��Ӧ��ƽ�������¶���������Ӧ������С�
��4�������������������ԭ��أ���������̼�������ԭ��ص������缫����Ϊ������̼Ϊ�����������Ӧ�÷���NO2�õ���ת��Ϊ�����ķ�Ӧ�����Է���ʽΪ��2NO2+8H++8e-=N2��+4H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.01 mol/L�Ĵ�����Һ�У�����1.00 mol/L��pH��7�Ĵ������Һ����ҺpH�����������Һ����仯��ͼ��ʾ�����з�����ȷ����

A. a�㣬pH��2
B. b�㣬c��CH3COO������c��NH![]() ��
��
C. c�㣬pH���ܴ���7
D. ab�Σ�������Һ��ϡ������ҺpH�������Ҫԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pKa=-lgKa��25��ʱ��H2SO3��pKa1=1.85��pKa2=7.19����0.1000molL-1NaOH��Һ�ζ�20.00mL0.1000molL-1H2SO3��Һ�����е�pH�仯��ͼ��ʾ������˵���������
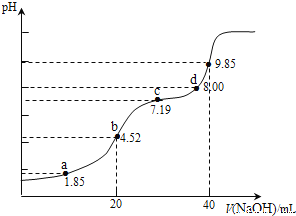
A. a��������Һ�У�3c(H2SO3)+3c(HSO3-)+3c(SO32-)=0.2000molL-1
B. b��������Һ�У�c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c��������Һ�У�c(SO32-)=c(HSO3)
D. d��������Һ�У�c(Na+)��c(SO32-)��c(HSO3-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ绯ѧԭ����ԭCO2��ȡZnC2O4��װ����ͼ��ʾ(���Һ���μӷ�Ӧ)������˵����ȷ����

A. ����H2SO4��Һ�����Һ
B. �����ӽ��QĤ����Ҫ�����lj���������
C. Pb�缫�ĵ缫��Ӧʽ��2CO2-2e-==C2O42-
D. ������·�К�����0.02mol���ӣ�Zn�缫��������0.65g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�ķ���ʽ����ȷ����
A. Na2Sˮ��Һ�ʼ��ԣ�S2-+2H2O![]() H2S+2OH��
H2S+2OH��
B. 0.1 mol��L-1 ��ˮ��pHΪ11��NH3��H2O![]() NH4��+ OH��
NH4��+ OH��
C. Al2S3��ˮ��Һ�в����ڣ�Al2S3+6H2O === 2Al(OH)3��+3H2S��
D. MgO����ϡ�����У�MgO+2H��===Mg2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
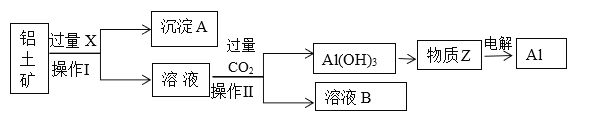
����Ŀ����ҵ������������Ҫ�ɷ�ΪAl2O3����Fe2O3�����ʣ�Ϊԭ��ұ�����Ĺ����������£�
��֪��2Al2O3![]() 4Al+3O2����
4Al+3O2����
��1�������������___________���õ��IJ���������_______________��
��2��X��___________��������ͨ�����CO2�����ӷ���ʽ��______________________________________��
��3������A����Ҫ�ɷ���________������������ʲôӦ�ã�________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����ˡ�������2016��ʮ���¼���֮һ��̼������أ����ԭ����ͼ��ʾ����֪��������Al2(C2O4)3��������ˮ���������й�˵����ȷ����
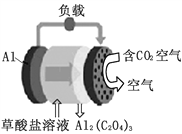
A. ��װ�ý�����ת��Ϊ��ѧ��
B. �����ĵ缫��ӦΪC2O42��-2e-===2CO2
C. ÿ����1molAl2(C2O4)3����6mol������������
D. ��������Һ�е�����������Al�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�е�Ԫ�ؼ��仯�����ת����ϵ���ش����⣺
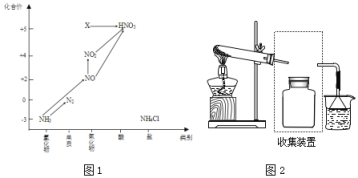
��1��ͼ1�У�X�Ļ�ѧʽΪ___���ӻ��ϼ��Ͽ���X����___�ԣ���������������ԭ������
��2���ش����й���NH3�����⣺
��ʵ���ҳ���NH4Cl��Ca(OH)2��ȡ�������÷�Ӧ�Ļ�ѧ����ʽΪ________��
�������Լ��������ڸ���NH3����___������ĸ����
A��Ũ���� B����ʯ�� C��NaOH����
����Ҫ�ռ�һƿ�������뽫����װ�ò�����������ͼ2����ڻ�������ͼ___��
�ܰ�������Ҫ�Ļ���ԭ�ϣ����Ժϳɶ������ʣ�д����������Ļ�ѧ����ʽ__________________________ ��
��3���ش����й���NO��NO2�����⣺
��������������װ�д�ת�����ɼ���β���Ի�������Ⱦ������β���е��к�����CO��NO��Ӧ��ת��Ϊ�������ŷţ�д����ط�Ӧ�Ļ�ѧ����ʽ��___________________
��NO��NO2��һ��������Ͽ��Ա�NaOH��Һ��ȫ���գ�д����ػ�ѧ����ʽ_____________��
��ҵ���������ð�ˮ����SO2��NO2��ԭ������ͼ��ʾ��
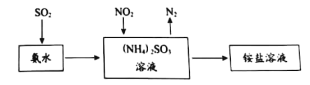
NO2�����չ��̵����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ӡȾ����ֽ���ڶ���ҵ�����Ź㷺��Ӧ�á��о�С����Na2CO3��Һ����SO2�Ʊ�Na2SO3����ʵ���������£�


�������Ͽ�֪����̼������Һͨ���������Ĺ����У���Һ���й���ֵ����������仯����ͼ����ʾ��
��1����ͼ�е���2��ʾ�����Ϊ ���ѧʽ����
��2��ʵ��ʱ������ӦII���м���NaOH��Һ��Ŀ���� ���û�ѧ����ʽ��ʾ����
��3�����ұ��涨��Ʒ��Na2SO3������������97.0%Ϊ�ŵ�Ʒ����93.0%Ϊһ��Ʒ��Ϊ��ȷ��ʵ�����ò�Ʒ�ĵȼ����о�С����������ַ������вⶨ��
������I����ȡ2.570g��Ʒ��������ˮ�ܽ⣬����������˫��ˮʹNa2SO3��ȫ��������Na2SO4���ټ��������BaCl2��Һ�����ó����������ˡ�ϴ�ӡ���������������Ϊ4.660g��ͨ������ȷ����Ʒ��Na2SO3������������д��������̣�
������II����ȡ1.326g��Ʒ�����100mL��Һ��ȡ25.00mL����Һ���μ�0.1250mol/L I2��Һ��ǡ��ʹNa2SO3��ȫ��������Na2SO4ʱ������I2��Һ20.00mL��ͨ������ȷ����Ʒ��Na2SO3������������д��������̣�
���ж�Na2SO3��Ʒ�ĵȼ�����˵�����ɡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com