
【题目】依据下图中氮元素及其化合物的转化关系,回答问题:
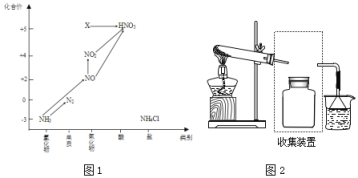
(1)图1中,X的化学式为___,从化合价上看,X具有___性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________。
②下列试剂不能用于干燥NH3的是___(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图___。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式__________________________ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:___________________
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式_____________。
工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
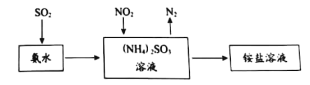
NO2被吸收过程的离子方程式是____________。
【答案】N2O5 氧化性; Ca(OH)2+2NH4Cl ![]() CaCl2 + 2NH3↑+2H2O A
CaCl2 + 2NH3↑+2H2O A 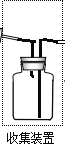 4NH3 + 5O2
4NH3 + 5O2![]() 4NO+6H2O 2NO + 2CO
4NO+6H2O 2NO + 2CO![]() N2+2CO2 NO+ NO2+2NaOH=2NaNO2+H2O NO2 +2SO32- == N2 + 2SO42-
N2+2CO2 NO+ NO2+2NaOH=2NaNO2+H2O NO2 +2SO32- == N2 + 2SO42-
【解析】
(1)X中氮元素化合价是+5价,氧化物的化学式为N2O5,氮元素处于最高价,因此X具有氧化性;
(2)①实验室常用NH4Cl与Ca(OH)2制备氨气,该反应的化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2 + 2NH3↑+2H2O;
CaCl2 + 2NH3↑+2H2O;
②A.氨气为碱性气体,且具有还原性,浓硫酸具有酸性和氧化性,会与氨气发生反应,故不能用浓硫酸干燥,正确;B.碱石灰可以干燥氨气,错误;C.NaOH固体可以干燥氨气,错误;故答案为A;
③氨气极易溶于水,比空气轻,收集方法只能用向下排空气法收集,导气管位置短进长出: ;
;
④氨气催化氧化的化学方程式为:4NH3 + 5O2 ![]() 4NO + 6H2O;
4NO + 6H2O;
(3)①汽车尾气中的有害气体CO和NO反应可转化为无害气体(N2、CO2)排放,CO中C的化合价升高2,NO中N的化合价降低2,根据化合价升降守恒和原子守恒可知,其化学反应方程式为2NO + 2CO![]() N2 + 2CO2;
N2 + 2CO2;
②NO中N为+2价,NO2中N为+4价,归中反应只能都转化为+3价,故其化学方程式为:NO+ NO2+2NaOH=2NaNO2+H2O;反应物是亚硫酸铵、二氧化氮,生成物是硫酸铵和氮气,则NO2被吸收过程的离子方程式是:NO2 +2SO32- == N2 + 2SO42-。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】贝诺酯是解热镇痛抗炎药,其结构如图所示。下列有关说法正确的是

A. 分子式为C17H14O5N
B. 贝诺酯能发生银镜反应
C. 1 mol贝诺酯与H2发生加成反应最多消耗8mol H2
D. 在氢氧化钠水溶液中水解可以得到3种有机物钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g)△H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g)△H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g)△H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的![]() 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。
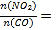
(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。
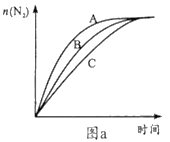
(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出了“积极参与全球环境治理,落实减排承诺”。其中氮的化合物的处理和利用是环境科学研究的热点。
(1)机动车排放的尾气中主要污染物为NOx ,可用 CH4 催化还原 NOx 以消除其污染。298 K时,1.0 g CH4 (g)与足量的NO气体完全反应生成N2、CO2和H2O(g),放出72. 5 kJ的热量。该反应的热化学方程式为_______________。
(2)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
ΔH1、ΔH2、ΔH3之间的关系为ΔH3=___________;K1、K2、K3的关系为K3=____________。
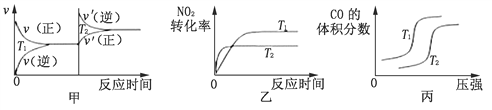
(3)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、NO2等有毒气体转化为无毒气体:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图像正确的是________(填序号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图像正确的是________(填序号)。
(4)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s) +2NO(g)![]() N2(g) + CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g) + CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
① T1℃时,该反应在0~20min的平均反应速率v(CO2)=__________________;该反应的平衡常数K= _____________;
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______(填序号);
A. 加入一定量的活性炭 B. 恒温恒压充入氩气
C. 适当缩小容器的体积 D. 加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则和原平衡相比,NO的转化率_____________(填“升高”或“降低”),ΔH_______0(填“﹥”、“﹤”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的前四周期元素,A是原子半径最小的元素,B元素有两个未成对电子,D元素的最外层电子是内层电子数的三倍,E的单质是自然界中最硬的金属,常用于制作合金,且其未成对电子数在同周期中最多。回答下列问题:
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是________,其价层电子排布图为____________,根据_____________原理,该基态原子的电子排布应使其能量处于最低状态。
(2)根据电子排布,C元素处于周期表中_______区;根据元素周期律,电负性B_______C,第一电离能C________D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空间构型是_____________;A与C以原子个数比2:1形成的分子中C原子的杂化方式为_________,它是_________分子(填“极性”或“非极性”),且该分子可以与很多金属离子形成配合物,其中提供孤对电子的原子是____________(填元素符号)。
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:
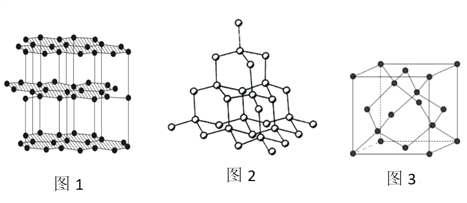
①图1所对应的同素异形体可以导电,试从其结构予以解释_________。
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为_____________。(![]() =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(aq,橙色)+H2O(l)![]() 2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
A. 上述反应平衡常数的表达式为:K=[c(H+)·c2(CrO42-)]/[c(Cr2O72-)·c(H2O)]
B. 实验①现象:溶液由橙色变为黄色,实验②现象:溶液由黄色变为橙色
C. 实验①和②的目的是探究H+浓度对上述平衡的影响
D. 预测稀释K2Cr2O7溶液时,溶液颜色由橙色变为黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,已知有机物A的相对分子质量是28,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种高聚物,生活中用于制造食物保鲜膜。
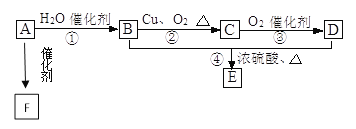
(1)请写出A的结构简式________、C的结构式__________;
(2)请写出B中官能团的电子式__________、D中官能团的名称__________;
(3)请写出下列反应的类型:①__________,②________,④__________。
(4)请写出下列物质转化的化学方程式:A→F ____________; B→C _______;B+D→E __________。
Ⅱ.在实验室可以用如图所示的装置进行B与D的反应,请回答下列问题:
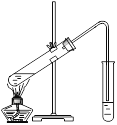
(1)装置中通蒸气的导管要插在_______溶液的液面上方,而不能插入溶液中的原因是为了________,该溶液的作用是____________________________________。
(2)若要把制得的乙酸乙酯分离出来,应采用的实验操作是______。
Ⅲ. 苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是苹果醋的主要成分,其结构简式如图所示,请回答下列问题:
![]()
(1)苹果酸的分子式为__________。
(2)1 mol苹果酸与足量金属钠反应,能生成标准状况下的氢气____L。
(3)在一定条件下,苹果酸可能与下列哪些物质发生反应?_________
A.氢氧化钠溶液 B.乙酸 C.碳酸氢钠溶液 D.乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化关系中,A是一种日常生活中最常见的溶剂,G气体溶于水显碱性,Y 是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。1mol B通过反应②得到1mol F,B中F的质量分数为72%。
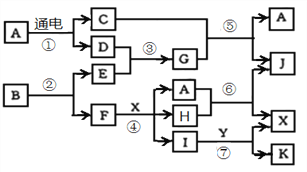
请按要求填空:
(1)B和G含有的共同元素在周期表中的位置是___________________。
(2)过量气体G与氯气反应可以生成一种单质和一种盐,该盐的电子式为 ________________________。
(3)写出反应④的离子方程式,并用单线桥标出电子转移情况__________________________。
(4)反应⑤的化学方程式为___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com