
����Ŀ����.��ͼ��ʾ����֪�л���A����Է���������28�����IJ����Ǻ���һ������ʯ�ͻ���ˮƽ�ı�־��B��D�����ճ�����ʳƷ�г������л��E�Ǿ���Ũ����ζ����������ˮ����״Һ�壬F��һ�ָ߾����������������ʳ�ﱣ��Ĥ��
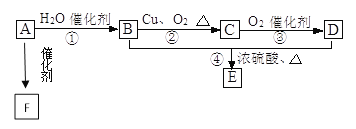
��1����д��A�Ľṹ��ʽ________��C�Ľṹʽ__________��
��2����д��B�й����ŵĵ���ʽ__________��D�й����ŵ�����__________��
��3����д�����з�Ӧ�����ͣ���__________����________����__________��
��4����д����������ת���Ļ�ѧ����ʽ��A��F ____________�� B��C _______��B+D��E __________��
��.��ʵ���ҿ�������ͼ��ʾ��װ�ý���B��D�ķ�Ӧ����ش��������⣺
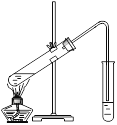
��1��װ����ͨ�����ĵ���Ҫ����_______��Һ��Һ���Ϸ��������ܲ�����Һ�е�ԭ����Ϊ��________������Һ��������____________________________________��
��2����Ҫ���Ƶõ������������������Ӧ���õ�ʵ�������______��
��. ƻ������һ����ƻ�����Ͷ��ɵ�������Ʒ�����нⶾ����֬��ҩЧ��ƻ������ƻ������Ҫ�ɷ֣���ṹ��ʽ��ͼ��ʾ����ش��������⣺
![]()
��1��ƻ����ķ���ʽΪ__________��
��2��1 molƻ���������������Ʒ�Ӧ�������ɱ�״���µ�����____L��
��3����һ�������£�ƻ���������������Щ���ʷ�����Ӧ��_________
A������������Һ B������ C��̼��������Һ D���Ҵ�
���𰸡�CH2��CH2 ![]()
![]() �Ȼ� �ӳɷ�Ӧ ������Ӧ ������Ӧ����ȡ����Ӧ��
�Ȼ� �ӳɷ�Ӧ ������Ӧ ������Ӧ����ȡ����Ӧ�� ![]()
![]()
![]() ����Na2CO3��Һ ��ֹ���� �������е��ܽ�ȸ�С�����������롢��ȥ�ֲ�Ʒ�е�������Ҵ� ��Һ C4H6O5 33.6 ABCD
����Na2CO3��Һ ��ֹ���� �������е��ܽ�ȸ�С�����������롢��ȥ�ֲ�Ʒ�е�������Ҵ� ��Һ C4H6O5 33.6 ABCD
��������
��������и��л�������ʼ���;�����ͼʾ��ת����ϵ�Ʋ��л�������࣬���������л���Ľṹ����Ӧ���͡�
I.���������Ϣ��A��ʯ�ͻ���ˮƽ�ı�־����AΪ��ϩ��A��ˮ��Ӧ�õ�B����BΪ�Ҵ���B������������Ӧ����CΪ��ȩ��DΪ���ᣬEΪ����������F��������ʳ�ﱣ��Ĥ����FΪ����ϩ��
��1����ϩ�Ľṹ��ʽΪ��CH2��CH2����ȩ�Ľṹʽ![]() ��
��
�ʴ�Ϊ��CH2��CH2��![]() ��
��
��2���Ҵ��й����ŵĵ���ʽΪ��![]() �������й����ŵ�����Ϊ���Ȼ���
�������й����ŵ�����Ϊ���Ȼ���
�ʴ𰸣�![]() ���Ȼ���
���Ȼ���
��3����Ӧ��Ϊ��ϩ��ˮ�ļӳɷ�Ӧ����Ӧ��Ϊ������Ӧ����Ӧ��Ϊ������Ӧ����ȡ����Ӧ����
�ʴ�Ϊ���ӳɷ�Ӧ��������Ӧ��������Ӧ����ȡ����Ӧ����
��4������������������ѧ����ʽΪ��A��F��![]() ��
��
B��C ![]() ��
��
B+D��E ![]() ��
��
�ʴ�Ϊ��![]() ��
��![]() ��
��![]() ��
��
��.��1��װ���Ҳ��Թ������ռ������������Թ���Ϊ����̼������Һ��Ϊ�˷�ֹ�������Բ��ܲ嵽Һ�����£�����Ϊ���������е��ܽ�ȸ�С�����������롢��ȥ�ֲ�Ʒ�е�������Ҵ���
�ʴ�Ϊ������Na2CO3��Һ����ֹ�������������е��ܽ�ȸ�С�����������롢��ȥ�ֲ�Ʒ�е�������Ҵ���
��2�����������뱥��̼������Һ�ֲ㣬Ӧ���õ�ʵ������Ƿ�Һ��
�ʴ�Ϊ����Һ��
��. ��1������ƻ����Ľṹ��ʽ�÷���ʽΪC4H6O5 ��
�ʴ�Ϊ��C4H6O5��
��2��1 molƻ�����к���2mol�Ȼ���1mol�ǻ�����n��H2��=2mol/2+1mol/2=1.5mol��V��H2��=22.4L/mol��1.5mol=33.6L��
�ʴ�Ϊ��33.6��
��3��ƻ�����к����Ȼ�������������������Һ��̼��������Һ��Ӧ��Ҳ�������Ҵ�����������Ӧ��ͬʱƻ�����к����ǻ������������ᷢ��������Ӧ��
�ʴ�Ϊ��ABCD��


 Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ绯ѧԭ����ԭCO2��ȡZnC2O4��װ����ͼ��ʾ(���Һ���μӷ�Ӧ)������˵����ȷ����

A. ����H2SO4��Һ�����Һ
B. �����ӽ��QĤ����Ҫ�����lj���������
C. Pb�缫�ĵ缫��Ӧʽ��2CO2-2e-==C2O42-
D. ������·�К�����0.02mol���ӣ�Zn�缫��������0.65g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�е�Ԫ�ؼ��仯�����ת����ϵ���ش����⣺
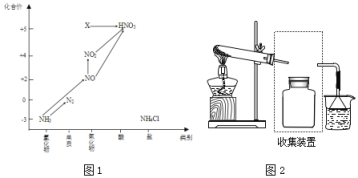
��1��ͼ1�У�X�Ļ�ѧʽΪ___���ӻ��ϼ��Ͽ���X����___�ԣ���������������ԭ������
��2���ش����й���NH3�����⣺
��ʵ���ҳ���NH4Cl��Ca(OH)2��ȡ�������÷�Ӧ�Ļ�ѧ����ʽΪ________��
�������Լ��������ڸ���NH3����___������ĸ����
A��Ũ���� B����ʯ�� C��NaOH����
����Ҫ�ռ�һƿ�������뽫����װ�ò�����������ͼ2����ڻ�������ͼ___��
�ܰ�������Ҫ�Ļ���ԭ�ϣ����Ժϳɶ������ʣ�д����������Ļ�ѧ����ʽ__________________________ ��
��3���ش����й���NO��NO2�����⣺
��������������װ�д�ת�����ɼ���β���Ի�������Ⱦ������β���е��к�����CO��NO��Ӧ��ת��Ϊ�������ŷţ�д����ط�Ӧ�Ļ�ѧ����ʽ��___________________
��NO��NO2��һ��������Ͽ��Ա�NaOH��Һ��ȫ���գ�д����ػ�ѧ����ʽ_____________��
��ҵ���������ð�ˮ����SO2��NO2��ԭ������ͼ��ʾ��
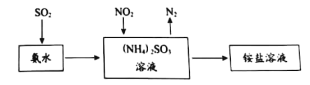
NO2�����չ��̵����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ĺ̶������ش��ʵĴ����ʹ���������ʳ������
(1)Ŀǰ�˹��̵���Ч��������ķ�����_______________(��һ����ѧ����ʽ��ʾ)��
(2)��Ȼ�緢����һ���̵���Ӧ��N2(B)+O2(g) ![]() 2NO(g)����֪N2��O2��NO���ַ����л�ѧ�����������յ���������Ϊ946kJ��mol-1��498kJ��mol-1��632kJ��mol-1����÷�Ӧ�ġ�H=____kJ��mol-1��
2NO(g)����֪N2��O2��NO���ַ����л�ѧ�����������յ���������Ϊ946kJ��mol-1��498kJ��mol-1��632kJ��mol-1����÷�Ӧ�ġ�H=____kJ��mol-1��
(3)��ѹ100kPaʱ����Ӧ2NO(g)+O2(g)![]() 2NO2(g)��NO��ƽ��ת�������¶ȵĹ�ϵ������ͼ1����Ӧ2NO2(g)
2NO2(g)��NO��ƽ��ת�������¶ȵĹ�ϵ������ͼ1����Ӧ2NO2(g)![]() N2O4(g)��NO2��ƽ��ת�������¶ȵĹ�ϵ������ͼ2��
N2O4(g)��NO2��ƽ��ת�������¶ȵĹ�ϵ������ͼ2��
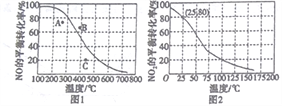
��ͼ1��A��B��C�����ʾ��ͬ�¶ȡ�ѹǿ��2NO(g)+O2(g)![]() 2NO2(g)�ﵽƽ��ʱNO��ת���ʣ���____________���Ӧ��ѹǿ���
2NO2(g)�ﵽƽ��ʱNO��ת���ʣ���____________���Ӧ��ѹǿ���
�ں�ѹ100kPa��25��ʱ��2NO2(g) ![]() N2O4(g)ƽ����ϵ��N2O4�����ʵ�������Ϊ______________����ʽ����ƽ�ⳣ��Kp=____________��(Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)
N2O4(g)ƽ����ϵ��N2O4�����ʵ�������Ϊ______________����ʽ����ƽ�ⳣ��Kp=____________��(Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)
(4)�����£�������������һ����NO2���壬����ͷ���뽺���ܷ⣬Ȼ��Ѹ�ٽ��������ѹ��Ϊԭ����һ�벢ʹ�����̶�����ʱ������Ͳ���ȸУ���������һ��ʱ�䡣�ӻ����̶�ʱ��ʼ�۲죬������ɫ��__________(������dz��)��ԭ����________________��[��֪2NO2(g)![]() N2O4(g)�ڼ����ڼ��ɴﵽ��ѧƽ��]
N2O4(g)�ڼ����ڼ��ɴﵽ��ѧƽ��]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����10 mLŨ��Ϊ0.01mol/L�İ�ˮ��Һ����μ���0.01mol/L��CH3COOH��Һ�����Һ��pH �����CH3COOH �����V֮��ı仯��������ͼ��ʾ������˵����ȷ����
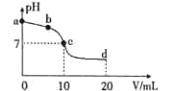
A. a����Һ��pH=12
B. b��ʱc(CH3COO-)>c(NH4+)
C. c��ʱˮ�ĵ���̶����
D. d�㴦�������:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3��H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������йع涨���龰��ա�
��1������ͼ�dz�ȥ����Ĥ��þ��Ͷ��ϡ�����в���������������ʱ��ı仯��ϵ������ǰ�γ��ָ߷����ҪӰ��������________��
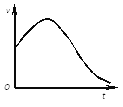
����ͼ�ǹ���������ø�Ĵ������·ֽ��������¶ȵı仯��ϵ�����ߺ�������½�����ҪӰ��������__��
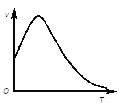
��2�����ù��ܺ�������ɽ�CO2��H2O(g)ת��ΪCH4��O2�����������ʱ���ڲ�ͬ������I��II��III�������£�CH4���������ʱ��ı仯��ͼ����0��15Сʱ�ڣ�CH4��ƽ����������I��II��III�Ӵ�С��˳��Ϊ_________������ţ���
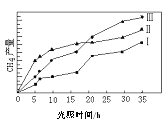
��3����TiO2��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ�ڲ�ͬ�¶��´����Ĵ�Ч����������������ʵĹ�ϵ��ͼ��
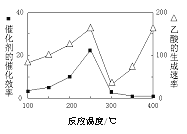
��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����_____________��
�ڵ��¶ȵ�ȡֵ��Χ��________ʱ���¶���Ӱ��������������ʵ���Ҫ���ء�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ӡȾ����ֽ���ڶ���ҵ�����Ź㷺��Ӧ�á��о�С����Na2CO3��Һ����SO2�Ʊ�Na2SO3����ʵ���������£�


�������Ͽ�֪����̼������Һͨ���������Ĺ����У���Һ���й���ֵ����������仯����ͼ����ʾ��
��1����ͼ�е���2��ʾ�����Ϊ ���ѧʽ����
��2��ʵ��ʱ������ӦII���м���NaOH��Һ��Ŀ���� ���û�ѧ����ʽ��ʾ����
��3�����ұ��涨��Ʒ��Na2SO3������������97.0%Ϊ�ŵ�Ʒ����93.0%Ϊһ��Ʒ��Ϊ��ȷ��ʵ�����ò�Ʒ�ĵȼ����о�С����������ַ������вⶨ��
������I����ȡ2.570g��Ʒ��������ˮ�ܽ⣬����������˫��ˮʹNa2SO3��ȫ��������Na2SO4���ټ��������BaCl2��Һ�����ó����������ˡ�ϴ�ӡ���������������Ϊ4.660g��ͨ������ȷ����Ʒ��Na2SO3������������д��������̣�
������II����ȡ1.326g��Ʒ�����100mL��Һ��ȡ25.00mL����Һ���μ�0.1250mol/L I2��Һ��ǡ��ʹNa2SO3��ȫ��������Na2SO4ʱ������I2��Һ20.00mL��ͨ������ȷ����Ʒ��Na2SO3������������д��������̣�
���ж�Na2SO3��Ʒ�ĵȼ�����˵�����ɡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����֮��ͨ��һ����Ӧ����ʵ��ͼʾ�仯����
���ʱ�� | ����ת����ϵ | a | b | c | d |
�� |
| NO | NO2 | N2 | HNO3 |
�� | Na2O | Na2O2 | Na | NaOH | |
�� | FeCl2 | FeCl3 | Fe | CuCl2 | |
�� | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. �٢ڢ� B. �ۢ�
C. �٢ۢ� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯ʾ��ͼ�������Ȼ�ѧ����ʽ��ȷ����( )
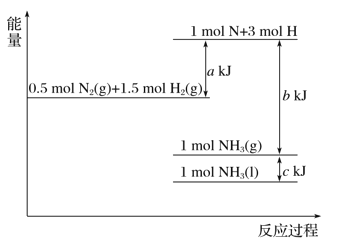
A. N2(g)��3H2(g)===2NH3(g) ��H����(b��a) kJ��mol��1
B. N2(g)��3H2(g)===2NH3(g) ��H����(a��b) kJ��mol��1
C. 2NH3(l)===N2(g)��3H2(g) ��H��2(a��b��c) kJ��mol��1
D. 2NH3(l)===N2(g)��3H2(g) ��H��2(b��c��a) kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com