
【题目】常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
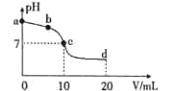
A. a点溶液的pH=12
B. b点时c(CH3COO-)>c(NH4+)
C. c点时水的电离程度最大
D. d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
【答案】C
【解析】A.氨水是弱电解质,部分部电离,则0.01molL-1的氨水,其pH<12,故A错误;B.c点溶液的pH=7,溶液中存在c(OH-)+c(CH3COO-)=c(NH4+)+c(H+),则c(OH-)=c(H+),c(CH3COO-)=c(NH4+),b点时c(CH3COO-)<c(NH4+),故B错误;C.c点溶液的pH=7,溶液中存在c(OH-)+c(CH3COO-)=c(NH4+)+c(H+),则c(OH-)=c(H+),c(CH3COO-)=c(NH4+),水解程度最大,水的电离程度最大,故C正确;D.d点溶液为等物质的量浓度的醋酸和醋酸铵,根据电荷守恒,c(OH-)+c(CH3COO-)=c(NH4+)+c(H+),根据物料守恒,c(CH3COO-)+ c(CH3COOH)=2c(NH4+)+ 2c(NH3·H2O),则因此2c(H+)+2c(NH4+)=2c(H+)+c(CH3COO-)+ c(CH3COOH)-2c(NH3·H2O)=2c(OH-)+2c(CH3COO-),则2c(H+)+c(CH3COO-)=2c(OH-)+2c(CH3COO-)-c(CH3COOH)+2c(NH3·H2O),因为醋酸铵溶液显中性,醋酸过量,以醋酸的电离为主,溶液呈酸性,c(CH3COO-)>c(CH3COOH),则2c(CH3COO-)+c(NH3·H2O)-c(CH3COOH)>0,因此2c(H+)+c(CH3COO-)>2c(OH-)+c(NH3·H2O),故D错误;故选C。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】碳热还原法广泛用于合金及材料的制备。回答下列问题:
(1)一种制备氮氧化铝的反应原理为23Al2O3+15C+5N2==2Al23O27N5+15CO,产物Al23O27N5中氮的化合价为______________________________。
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Al2O3 (s)+3C(s)==Al2OC(s)+2CO(g)△H1
2Al2OC(s)+3C(s)==Al4C3(s)+2CO(g)△H2
2Al2O3 (s)+9C(s)== Al4C3 (s)+6CO(g)△H3
①△H3=_________(用△H1、△H2表示)。
②Al4C3可与足量盐酸反应制备一种最简单的烃,该反应的化学方程式为__________________________。(3)下列是碳热还原制锰合金的三个反应,CO与CO2平衡分压比的自然对数值(1nK=2.303lgK)与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数。分压=总压×气体的物质的量分数)。

I.Mn3C(s)+4CO2(g) ![]() 3MnO(s)+5CO(g)Kp(I)
3MnO(s)+5CO(g)Kp(I)
II.Mn(s)+CO2(g) ![]() MnO(s)+CO(g) Kp(II)
MnO(s)+CO(g) Kp(II)
III.Mn3C(s)+CO2(g) ![]() 3Mn(s)+2CO(g)Kp(III)
3Mn(s)+2CO(g)Kp(III)
①△H>0的反应是__________________(填“I”“II”或“I”)。
②1200K时,在一体积为2L的恒容密闭容器中有17.7gMn3C(s)和0.4molCO2,只发生反应I,5min后达到平衡,此时CO的浓度为0.125mol/L,则0~5min内V(CO2)=____________。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应II,下列能说明反应II达到平衡的是____________(填字母)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
④向恒容密闭容器中加入Mn3C并充入0.1molCO2,若只发生反应III,则在A点反应达到平衡。当容器的总压为akPa时,CO2的转化率为______________;A点对应温度下的Kp(III)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的前四周期元素,A是原子半径最小的元素,B元素有两个未成对电子,D元素的最外层电子是内层电子数的三倍,E的单质是自然界中最硬的金属,常用于制作合金,且其未成对电子数在同周期中最多。回答下列问题:
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是________,其价层电子排布图为____________,根据_____________原理,该基态原子的电子排布应使其能量处于最低状态。
(2)根据电子排布,C元素处于周期表中_______区;根据元素周期律,电负性B_______C,第一电离能C________D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空间构型是_____________;A与C以原子个数比2:1形成的分子中C原子的杂化方式为_________,它是_________分子(填“极性”或“非极性”),且该分子可以与很多金属离子形成配合物,其中提供孤对电子的原子是____________(填元素符号)。
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:
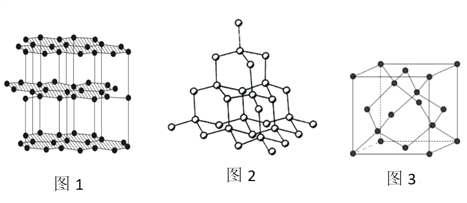
①图1所对应的同素异形体可以导电,试从其结构予以解释_________。
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为_____________。(![]() =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(aq,橙色)+H2O(l)![]() 2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
A. 上述反应平衡常数的表达式为:K=[c(H+)·c2(CrO42-)]/[c(Cr2O72-)·c(H2O)]
B. 实验①现象:溶液由橙色变为黄色,实验②现象:溶液由黄色变为橙色
C. 实验①和②的目的是探究H+浓度对上述平衡的影响
D. 预测稀释K2Cr2O7溶液时,溶液颜色由橙色变为黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为两种金属组成的合金,发生如下图所示的变化:

试填写以下空白:
(1)合金A由________和________组成。
(2)写出下列变化的离子方程式。
C→E______________________________________________________________;
D→F______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,已知有机物A的相对分子质量是28,它的产量是衡量一个国家石油化工水平的标志,B和D都是日常生活食品中常见的有机物,E是具有浓郁香味、不易溶于水的油状液体,F是一种高聚物,生活中用于制造食物保鲜膜。
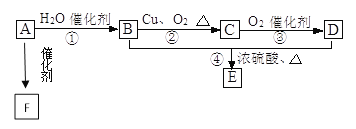
(1)请写出A的结构简式________、C的结构式__________;
(2)请写出B中官能团的电子式__________、D中官能团的名称__________;
(3)请写出下列反应的类型:①__________,②________,④__________。
(4)请写出下列物质转化的化学方程式:A→F ____________; B→C _______;B+D→E __________。
Ⅱ.在实验室可以用如图所示的装置进行B与D的反应,请回答下列问题:
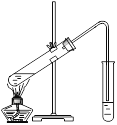
(1)装置中通蒸气的导管要插在_______溶液的液面上方,而不能插入溶液中的原因是为了________,该溶液的作用是____________________________________。
(2)若要把制得的乙酸乙酯分离出来,应采用的实验操作是______。
Ⅲ. 苹果醋是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果酸是苹果醋的主要成分,其结构简式如图所示,请回答下列问题:
![]()
(1)苹果酸的分子式为__________。
(2)1 mol苹果酸与足量金属钠反应,能生成标准状况下的氢气____L。
(3)在一定条件下,苹果酸可能与下列哪些物质发生反应?_________
A.氢氧化钠溶液 B.乙酸 C.碳酸氢钠溶液 D.乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2。(乙烯的制取装置略)
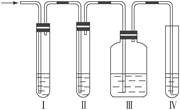
①Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛入的试剂是:Ⅰ______、Ⅱ______、Ⅲ______、Ⅳ______。(将下列有关试剂的序号填入空格内)
A. 品红溶液 B. NaOH溶液 C. 浓H2SO4 D. 酸性KMnO4溶液
②能说明SO2气体存在的现象是____________________。
③使用装置Ⅲ的目的是____________________________。
④确定含有乙烯的现象是_________________________。
(2)取一支试管,向其中加入10mL溴水,再加入5mL正己烷(分子式为C6H14,结构简式为CH3CH2CH2CH2CH2CH3)。将此试管中的混合液在光照下振荡后静置,液体分为几乎都是无色的上、下两层。用玻璃棒蘸取浓氨水伸入试管内液面上方,有白烟出现。
① 请写出生成白烟的化学反应方程式:_____________________________。
② 该实验证明了这是一个__________。
A.取代反应 B.加成反应 C.氧化反应 D.水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子化合物M(仅含三种元素)是一种镁基储氢材料。为探究M的组成和性质,设计并完成如下实验:
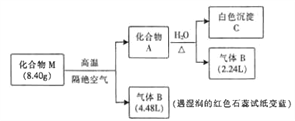
已知:气体的体积均在标准状况下测定,化合物A仅含两种元素。
请回答:
(1)化合物M中阳离子和阴离子的个数比为1:2,则M的化学式为_______________。
(2)化合物A 与H2O反应的化学方程式_______________。
(3)镁条在足量的气体B中燃烧可生成化合物M 和气体D,则D的分子式为_______________。
(4)研究表明液态B也是一种良好的储氢物质,其储氢容量可达17.6%,已知液态B中存在类似水的电离(2H2O![]() H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
①液态B的电离方程式________________。
②电解时,阴极的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求填空:
(1)化学反应过程中,不仅有物质的变化,还伴随有能量的变化。根据下图写出反应的热化学方程式:_________________________________。

(2)化学反应速率和化学平衡是化学反应原理的重要组成部分。
将4.0mol PCl3和2.0 mol Cl2充入10 L恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
①在0~2 min 内,用Cl2 表示的反应速率为:v(Cl2)=_____ mol·L-l·min-1;
②达到平衡时,PCl3的转化率为___________________。
③如果再通入1.0 mol Cl2,相同温度下重新达到平衡时,PCl5的物质的量________________。(填标号)
A.增大 B.减小 C.不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com