
【题目】某离子化合物M(仅含三种元素)是一种镁基储氢材料。为探究M的组成和性质,设计并完成如下实验:
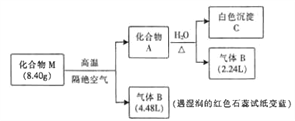
已知:气体的体积均在标准状况下测定,化合物A仅含两种元素。
请回答:
(1)化合物M中阳离子和阴离子的个数比为1:2,则M的化学式为_______________。
(2)化合物A 与H2O反应的化学方程式_______________。
(3)镁条在足量的气体B中燃烧可生成化合物M 和气体D,则D的分子式为_______________。
(4)研究表明液态B也是一种良好的储氢物质,其储氢容量可达17.6%,已知液态B中存在类似水的电离(2H2O![]() H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
①液态B的电离方程式________________。
②电解时,阴极的电极反应式________________。
【答案】 Mg(NH2)2 Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑ H2 2NH3=NH4++NH2- 2NH3+2e-=H2↑+2NH2-或2NH4++2e-=H2↑+2NH3
3Mg(OH)2↓+2NH3↑ H2 2NH3=NH4++NH2- 2NH3+2e-=H2↑+2NH2-或2NH4++2e-=H2↑+2NH3
【解析】气体B能使湿润的红色石蕊试纸变蓝,则B为NH3,气体的体积均在标准状况下测定,某物质M (仅含三种元素)是一种镁基储氢材料,M高温分解生成固体A和气体B为氨气,物质的量=![]() =0.2mol,证明M中含有N、H、Mg元素,化合物A只含两种元素,和水反应生成氨气和白色沉淀C,固体A和水反应生成氨气物质的量=
=0.2mol,证明M中含有N、H、Mg元素,化合物A只含两种元素,和水反应生成氨气和白色沉淀C,固体A和水反应生成氨气物质的量=![]() =0.1mol,白色沉淀C为氢氧化镁沉淀,则A为Mg3N2,物质的量为0.05mol,元素守恒得到Mg元素物质的量0.15mol,所含氮元素0.1mol,M分解生成氨气0.2mol,则M中含氮元素0.2mol+0.1mol=0.3mol,所含氢元素物质的量=
=0.1mol,白色沉淀C为氢氧化镁沉淀,则A为Mg3N2,物质的量为0.05mol,元素守恒得到Mg元素物质的量0.15mol,所含氮元素0.1mol,M分解生成氨气0.2mol,则M中含氮元素0.2mol+0.1mol=0.3mol,所含氢元素物质的量=![]() =0.6mol,M中元素物质的量之比为:n(Mg):n(N):n(H)=0.15:0.3:0.6=1:2:4。
=0.6mol,M中元素物质的量之比为:n(Mg):n(N):n(H)=0.15:0.3:0.6=1:2:4。
(1)化合物M中阳离子和阴离子的个数比为1:2,M中元素物质的量之比为:n(Mg):n(N):n(H)=0.15:0.3:0.6=1:2:4,则M的化学式为Mg(NH2)2,故答案为:Mg(NH2)2;
(2)化合物A为Mg3N2,与H2O反应的化学方程式为Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑,故答案为:Mg3N2+6H2O
3Mg(OH)2↓+2NH3↑,故答案为:Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑;。
3Mg(OH)2↓+2NH3↑;。
(3)镁条在足量的氨气中燃烧可生成化合物M[Mg(NH2)2]和气体D,在M中n(N):n(H)=1:2,而氨气中n(N):n(H)=1:3,则D中含有H元素,分子式为H2,故答案为:H2;
(4) ①液态氨中存在类似水的电离(2H2O![]() H3O++OH-),则氨的电离方程式为2NH3=NH4++NH2-,故答案为:2NH3=NH4++NH2-;
H3O++OH-),则氨的电离方程式为2NH3=NH4++NH2-,故答案为:2NH3=NH4++NH2-;
②用Pt电极对液态B进行电解可产生两种气态单质,分别为氮气和氢气,电解时,阴极发生还原反应,电极反应式为2NH4++2e-=H2↑+2NH3,故答案为:2NH4++2e-=H2↑+2NH3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示,已知草酸铝[Al2(C2O4)3]难溶于水。则下列有关说法正确的是
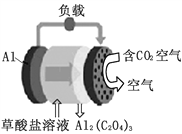
A. 该装置将电能转变为化学能
B. 正极的电极反应为C2O42--2e-===2CO2
C. 每生成1molAl2(C2O4)3,有6mol电子流过负载
D. 草酸盐溶液中的阳离子移向Al电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
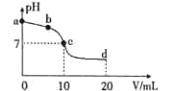
A. a点溶液的pH=12
B. b点时c(CH3COO-)>c(NH4+)
C. c点时水的电离程度最大
D. d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:


查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如右图是所示。
(1)右图中的线2表示的组分为 (填化学式)。
(2)实验时,“反应II”中加入NaOH溶液的目的是 (用化学方程式表示)。
(3)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了两种方法进行测定。
①方法I:称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00mL。通过计算确定产品中Na2SO3的质量分数(写出计算过程)
③判断Na2SO3产品的等级,并说明理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳加氢合成乙烯的反应如下:2CO2(g )+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。
已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2 ΔH1=a kJ/mol;
②2H2(g)+O2(g)=2H2O(1)ΔH2=bkJ/mol;
③H2O(1)=H2O(g) ΔH3=c kJ/mol;
请回答:
(1)ΔH=____kJ/mol。(用a、b、c 表示)
(2)在催化剂[Fe3(CO)12/ZSM-5]、空速1200 h-1 条件下,温度、压强、氢碳比[n(H2)/n(CO2)=x]对CO2平衡转化率及温度对催化效率影响如图1所示。
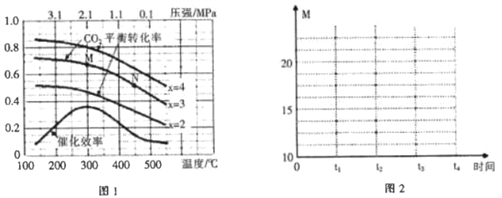
①下列有关说法正确的是________(填字母)。
A.ΔH>0
B.增大氢碳比,可以提高CO2的平衡转化率
C.温度低于300℃时,随温度升高乙烯的产率增大
D.平衡常数:K(M)>K(N)
E.为提高CO2的平衡转化率,工业生产中应在尽可能低的温度下合成乙烯
②M点时,CO2的平衡转化率为2/3,则此时平衡体系中乙烯的体积分数为_________。
③工业生产中压强一般控制在2.1~2.6 MPa之间,理由是____________________________。
(3)恒温(300℃),在体积为1L的恒容容器中以n(H2)/n(CO2)=3的投料比加入反应物,至t1时达到平衡。t2时将容器体积瞬间扩大至2 L并保持不变,t3时重新达平衡。在图2中绘制0~t4时间段内,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现图示变化的是
物质编号 | 物质转化关系 | a | b | c | d |
① |
| NO | NO2 | N2 | HNO3 |
② | Na2O | Na2O2 | Na | NaOH | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. ①②③ B. ③④
C. ①③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制 1mol/L 的 NaOH 溶液240mL,
(1)实验操作中用天平称量________g NaOH 固体;
(2)容量瓶在使用前的操作是________________________
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是_________。
①称量氢氧化钠固体的时间过长。
②容量瓶用蒸馏水洗涤后残留有少量的水。
③溶液未冷却即转入容量瓶。
④在转移氢氧化钠溶液后未洗涤烧杯。
⑤定容时俯视刻度线。
⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线。
(4)取配制的 1mol/L 的 NaOH 溶液10 mL,再稀释成 100 m L,再从中取出 10 mL,这 10 mL 溶液的物质的量浓度为________。
(5)取配制的1mol/L 的 NaOH 溶液10 mL,加入足量的氧化铝充分反应(溶液体积保持不变),得到的溶液的浓度为_____________,发生反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
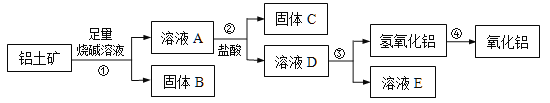
(1)固体B的主要用途有(写出1条即可)________________。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是 ; ;
第③步中,生成氢氧化铝的化学方程式是 。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是_______。(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1 mol电子,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 23 g Na与足量H2O反应完全后可生成NA个H2分子
B. 1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4 L Cl2含NA个原子
D. 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com