
【题目】实验室配制 1mol/L 的 NaOH 溶液240mL,
(1)实验操作中用天平称量________g NaOH 固体;
(2)容量瓶在使用前的操作是________________________
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是_________。
①称量氢氧化钠固体的时间过长。
②容量瓶用蒸馏水洗涤后残留有少量的水。
③溶液未冷却即转入容量瓶。
④在转移氢氧化钠溶液后未洗涤烧杯。
⑤定容时俯视刻度线。
⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线。
(4)取配制的 1mol/L 的 NaOH 溶液10 mL,再稀释成 100 m L,再从中取出 10 mL,这 10 mL 溶液的物质的量浓度为________。
(5)取配制的1mol/L 的 NaOH 溶液10 mL,加入足量的氧化铝充分反应(溶液体积保持不变),得到的溶液的浓度为_____________,发生反应的离子方程式为___________________。
【答案】10.0 检查容量瓶是否漏水 ③⑤ 0.1mol/L 1mol/L Al2 O3+2OH-===2AlO2-+ H2O
【解析】
根据中学实验室里容量瓶的规格,配制240mL溶液应选用250mL的容量瓶。
(1)配制1mol/LNaOH溶液250mL需要NaOH的质量=1mol/L×0.25L×40g/mol=10.0g。即用天平称量10.0gNaOH固体。
(2)容量瓶在使用前需要检查容量瓶是否漏水,只有不漏水的容量瓶才能使用。
(3)①因氢氧化钠固体易吸收空气中的水蒸气和CO2,如果称量氢氧化钠固体的时间过长,则称量的氢氧化钠固体中混有杂质,即溶质NaOH的物质的量(![]() )减小,根据公式
)减小,根据公式![]() =
=![]() 可知物质的量浓度偏低。①项错误;②容量瓶用蒸馏水洗涤后残留有少量的水,既不影响溶质的物质的量(
可知物质的量浓度偏低。①项错误;②容量瓶用蒸馏水洗涤后残留有少量的水,既不影响溶质的物质的量(![]() ),也不影响溶液体积(V),根据公式
),也不影响溶液体积(V),根据公式![]() =
=![]() 可知溶液浓度不受影响。②项错误;③溶液未冷却即转入容量瓶,由于热胀冷缩,所配制的溶液冷却到室温时溶液体积(V)将减小,根据公式
可知溶液浓度不受影响。②项错误;③溶液未冷却即转入容量瓶,由于热胀冷缩,所配制的溶液冷却到室温时溶液体积(V)将减小,根据公式![]() =
=![]() 可知溶液浓度偏大。③项正确;④在转移氢氧化钠溶液后未洗涤烧杯,则溶质NaOH的物质的量(
可知溶液浓度偏大。③项正确;④在转移氢氧化钠溶液后未洗涤烧杯,则溶质NaOH的物质的量(![]() )减小,根据公式
)减小,根据公式![]() =
=![]() 可知物质的量浓度偏低。④项错误;⑤定容时俯视刻度线,使容量瓶中液面低于刻度线,则所配溶液的体积(V)减小,根据公式
可知物质的量浓度偏低。④项错误;⑤定容时俯视刻度线,使容量瓶中液面低于刻度线,则所配溶液的体积(V)减小,根据公式![]() =
=![]() 可知溶液浓度偏大。⑤项正确;⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线,则所配溶液的体积(V)增大,根据公式
可知溶液浓度偏大。⑤项正确;⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线,则所配溶液的体积(V)增大,根据公式![]() =
=![]() 可知溶液浓度偏小。⑥项错误;答案选③⑤。
可知溶液浓度偏小。⑥项错误;答案选③⑤。
(4)将1mol/LNaOH溶液10 mL稀释成100 mL时,NaOH的浓度c=![]() =0.1mol/L,因为溶液的圴一性,故这10mL溶液的物质的量浓度仍为0.1mol/L。
=0.1mol/L,因为溶液的圴一性,故这10mL溶液的物质的量浓度仍为0.1mol/L。
(5)氧化铝具有两性,能与NaOH溶液反应,其离子方程式为Al2O3+2OH-=2AlO2-+H2O,所以NaOH完全与氧化铝反应后,所得溶液中溶质是NaAlO2,10 mL 1mol/LNaOH溶液中含有NaOH的物质的量n(NaOH)=1mol/L×0.01L=0.01mol,根据离子方程式计量关系知所得溶液中NaAlO2的物质的量=n(NaOH)=0.01mol,则所得溶液的浓度![]() =
=![]() =1mol/L。氧化铝与氢氧化钠溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。/span>
=1mol/L。氧化铝与氢氧化钠溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。/span>


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的前四周期元素,A是原子半径最小的元素,B元素有两个未成对电子,D元素的最外层电子是内层电子数的三倍,E的单质是自然界中最硬的金属,常用于制作合金,且其未成对电子数在同周期中最多。回答下列问题:
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是________,其价层电子排布图为____________,根据_____________原理,该基态原子的电子排布应使其能量处于最低状态。
(2)根据电子排布,C元素处于周期表中_______区;根据元素周期律,电负性B_______C,第一电离能C________D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空间构型是_____________;A与C以原子个数比2:1形成的分子中C原子的杂化方式为_________,它是_________分子(填“极性”或“非极性”),且该分子可以与很多金属离子形成配合物,其中提供孤对电子的原子是____________(填元素符号)。
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:
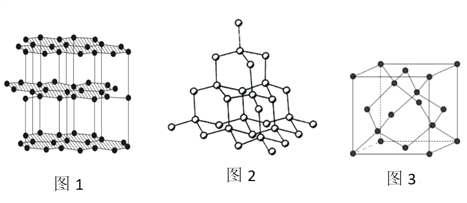
①图1所对应的同素异形体可以导电,试从其结构予以解释_________。
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为_____________。(![]() =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2。(乙烯的制取装置略)
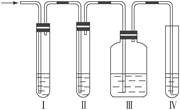
①Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛入的试剂是:Ⅰ______、Ⅱ______、Ⅲ______、Ⅳ______。(将下列有关试剂的序号填入空格内)
A. 品红溶液 B. NaOH溶液 C. 浓H2SO4 D. 酸性KMnO4溶液
②能说明SO2气体存在的现象是____________________。
③使用装置Ⅲ的目的是____________________________。
④确定含有乙烯的现象是_________________________。
(2)取一支试管,向其中加入10mL溴水,再加入5mL正己烷(分子式为C6H14,结构简式为CH3CH2CH2CH2CH2CH3)。将此试管中的混合液在光照下振荡后静置,液体分为几乎都是无色的上、下两层。用玻璃棒蘸取浓氨水伸入试管内液面上方,有白烟出现。
① 请写出生成白烟的化学反应方程式:_____________________________。
② 该实验证明了这是一个__________。
A.取代反应 B.加成反应 C.氧化反应 D.水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子化合物M(仅含三种元素)是一种镁基储氢材料。为探究M的组成和性质,设计并完成如下实验:
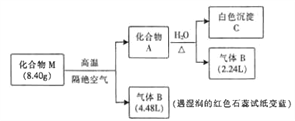
已知:气体的体积均在标准状况下测定,化合物A仅含两种元素。
请回答:
(1)化合物M中阳离子和阴离子的个数比为1:2,则M的化学式为_______________。
(2)化合物A 与H2O反应的化学方程式_______________。
(3)镁条在足量的气体B中燃烧可生成化合物M 和气体D,则D的分子式为_______________。
(4)研究表明液态B也是一种良好的储氢物质,其储氢容量可达17.6%,已知液态B中存在类似水的电离(2H2O![]() H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
①液态B的电离方程式________________。
②电解时,阴极的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化关系中,A是一种日常生活中最常见的溶剂,G气体溶于水显碱性,Y 是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。1mol B通过反应②得到1mol F,B中F的质量分数为72%。
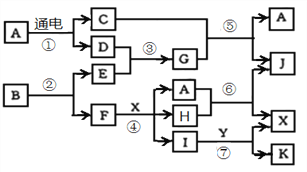
请按要求填空:
(1)B和G含有的共同元素在周期表中的位置是___________________。
(2)过量气体G与氯气反应可以生成一种单质和一种盐,该盐的电子式为 ________________________。
(3)写出反应④的离子方程式,并用单线桥标出电子转移情况__________________________。
(4)反应⑤的化学方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO和CO2的混合气体,通过过量的Na2O2后,剩余气体体积为原来的一半,则NO和CO2的体积比为(不考虑NOx与Na2O2的反应及2NO2![]() N2O4)( )
N2O4)( )
A. 2:1 B. 1:2 C. 1:4 D. ≤1:1的任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求填空:
(1)化学反应过程中,不仅有物质的变化,还伴随有能量的变化。根据下图写出反应的热化学方程式:_________________________________。

(2)化学反应速率和化学平衡是化学反应原理的重要组成部分。
将4.0mol PCl3和2.0 mol Cl2充入10 L恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
①在0~2 min 内,用Cl2 表示的反应速率为:v(Cl2)=_____ mol·L-l·min-1;
②达到平衡时,PCl3的转化率为___________________。
③如果再通入1.0 mol Cl2,相同温度下重新达到平衡时,PCl5的物质的量________________。(填标号)
A.增大 B.减小 C.不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列实验仪器和实验操作的有关问题。


(1)图A中试管夹的作用是______________________。
(2)指出图B中的错误操作是____________________________________。
(3)图C、D是某同学配制50 g质量分数为6%的氯化钠溶液时,在称量和量取两个操作步骤中出现的情况:
①如图C所示:在称量氯化钠的操作过程中,发现指针偏右,则继续进行的操作是______________,至天平平衡。
②如图D所示,量取水时,仰视读数,所得溶液中溶质的质量分数会______________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com