
【题目】A、B、C、D、E为原子序数依次增大的前四周期元素,A是原子半径最小的元素,B元素有两个未成对电子,D元素的最外层电子是内层电子数的三倍,E的单质是自然界中最硬的金属,常用于制作合金,且其未成对电子数在同周期中最多。回答下列问题:
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是________,其价层电子排布图为____________,根据_____________原理,该基态原子的电子排布应使其能量处于最低状态。
(2)根据电子排布,C元素处于周期表中_______区;根据元素周期律,电负性B_______C,第一电离能C________D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空间构型是_____________;A与C以原子个数比2:1形成的分子中C原子的杂化方式为_________,它是_________分子(填“极性”或“非极性”),且该分子可以与很多金属离子形成配合物,其中提供孤对电子的原子是____________(填元素符号)。
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:
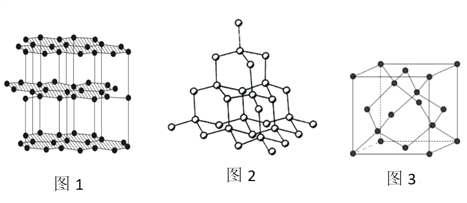
①图1所对应的同素异形体可以导电,试从其结构予以解释_________。
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为_____________。(![]() =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
【答案】 光谱分析  能量最低原理 P 小于 大于 V形 SP3 极性 N 石墨的片层结构上所有的P轨道互相平行且相互重叠,使P轨道中的电子可在整个碳原子平面中运动。 34.0%
能量最低原理 P 小于 大于 V形 SP3 极性 N 石墨的片层结构上所有的P轨道互相平行且相互重叠,使P轨道中的电子可在整个碳原子平面中运动。 34.0%
【解析】(1)光谱分析利用原子的特征光谱对原子进行鉴定,根据能量最低原理,3d轨道和4s轨道半充满状态最稳定,故Cr原子的电子排布较特殊;利用原子发生跃迁时吸收或释放出的光用于鉴定Cr元素,该方法是光谱分析,其价层电子排布图为 ,根据能量最低原理原理,该基态原子的电子排布应使其能量处于最低状态;(2)可以推测A为H,D可以推测为O,则B为C,而C只能是N,N处于P区,电负性同一周期从左到右增大,则C小于N,第一电离能由于N原子处于半充满状态,能量低,第一电离能大,故N大于O;(3)H2O的构型为V形,N2H4中N原子有孤对电子,有三对成键电子对,故价层电子对为4,为SP3杂化,由于N2H4的非对称结构,是极性分子;N原子可以提供孤独电子形成配位键,故其中提供孤对电子的原子是N;(4)①石墨的片层结构上所有的P轨道互相平行且相互重叠,使P轨道中的电子可在整个碳原子平面中运动,故能导电;②该晶胞体对角线应该是5个C原子无隙并置,则体对角线长为8a,该晶胞中含8个C原子,列式为(8×4/3πa3)/ (8a/
,根据能量最低原理原理,该基态原子的电子排布应使其能量处于最低状态;(2)可以推测A为H,D可以推测为O,则B为C,而C只能是N,N处于P区,电负性同一周期从左到右增大,则C小于N,第一电离能由于N原子处于半充满状态,能量低,第一电离能大,故N大于O;(3)H2O的构型为V形,N2H4中N原子有孤对电子,有三对成键电子对,故价层电子对为4,为SP3杂化,由于N2H4的非对称结构,是极性分子;N原子可以提供孤独电子形成配位键,故其中提供孤对电子的原子是N;(4)①石墨的片层结构上所有的P轨道互相平行且相互重叠,使P轨道中的电子可在整个碳原子平面中运动,故能导电;②该晶胞体对角线应该是5个C原子无隙并置,则体对角线长为8a,该晶胞中含8个C原子,列式为(8×4/3πa3)/ (8a/ ![]() )3 =34%。
)3 =34%。


科目:高中化学 来源: 题型:
【题目】下列反应所得产物一定不存在同分异构体的是
A. 异戊二烯与(![]() )等物质的量的Br2反应
)等物质的量的Br2反应
B. 2-氯丁烷与(![]() )NaOH乙醇溶液共热
)NaOH乙醇溶液共热
C. 甲苯与Cl2在一定条件下发生取代反应
D. 邻羟基苯甲酸(![]() )与NaHCO3溶液反应
)与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. Na2S水溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B. 0.1 mol·L-1 氨水的pH为11:NH3·H2O![]() NH4++ OH-
NH4++ OH-
C. Al2S3在水溶液中不存在:Al2S3+6H2O === 2Al(OH)3↓+3H2S↑
D. MgO溶于稀硫酸中:MgO+2H+===Mg2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示,已知草酸铝[Al2(C2O4)3]难溶于水。则下列有关说法正确的是
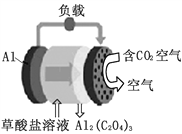
A. 该装置将电能转变为化学能
B. 正极的电极反应为C2O42--2e-===2CO2
C. 每生成1molAl2(C2O4)3,有6mol电子流过负载
D. 草酸盐溶液中的阳离子移向Al电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2、CO可与H2在一定条件下反应合成二甲醚(CH3OCH3)、甲醇(CH3OH)、草酸(H2C2O4)等化工原料。
(1)二甲醚可作为绿色环保型能源。二甲醚空气燃料电池的工作原理如图所示。该电池工作时,c通入的物质为______________ ,该电极的电极反应式为_______________。
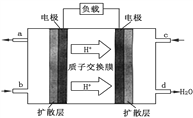
(2)某同学用甲醇和其它试剂组装了如下图所示装置,来研究有关电化学问题(甲、乙、丙三池中电解质足量)。当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
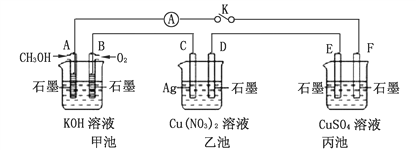
①丙池中F电极为____________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为_______________;
②若丙池溶液的体积为500 mL,当乙池中C极质量减轻5.4g时,丙池溶液的pH为_______(忽略溶液体积的变化);
③一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是______ (填序号)。
A. Cu B. CuO C. Cu(OH)2 D. Cu2(OH)2CO3
(3)已知:常温下,H2C2O4的电离常数分别是Ka1≈5.0×10-2,Ka2≈6.0×l0-5。草酸的钾盐有K2C2O4、KHC2O4。常温下,KHC2O4的水解常数Kh2=___________,KHC2O4溶液的pH______7(填“﹥”、“﹤”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图中氮元素及其化合物的转化关系,回答问题:
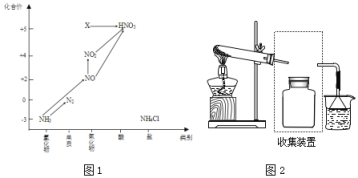
(1)图1中,X的化学式为___,从化合价上看,X具有___性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________。
②下列试剂不能用于干燥NH3的是___(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图___。
④氨气是重要的化工原料,可以合成多种物质,写出其催化氧化的化学方程式__________________________ 。
(3)回答下列关于NO、NO2的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:___________________
②NO和NO2按一定比例混合可以被NaOH溶液完全吸收,写出相关化学方程式_____________。
工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
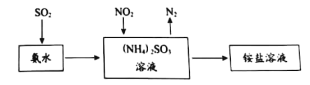
NO2被吸收过程的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480 mL 1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有______ 、 ___。
(2)下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是_______(填操作序号)。
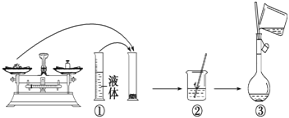
(3)称取NaOH固体时,所需砝码的质量为___________(填写字母)
A.19.2g B.20g C.19.2g ~20g D.大于20g
(4)在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的代号)_____________
①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)下列操作会导致所配溶液的物质的量浓度偏高的是_________
A.NaOH固体长期暴露在空气中
B.用水溶解NaOH固体后,立即转入容量瓶中定容
C.称量碳酸钠固体时,若将物质和砝码放反
D.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
E.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
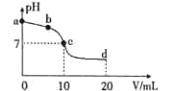
A. a点溶液的pH=12
B. b点时c(CH3COO-)>c(NH4+)
C. c点时水的电离程度最大
D. d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制 1mol/L 的 NaOH 溶液240mL,
(1)实验操作中用天平称量________g NaOH 固体;
(2)容量瓶在使用前的操作是________________________
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是_________。
①称量氢氧化钠固体的时间过长。
②容量瓶用蒸馏水洗涤后残留有少量的水。
③溶液未冷却即转入容量瓶。
④在转移氢氧化钠溶液后未洗涤烧杯。
⑤定容时俯视刻度线。
⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线。
(4)取配制的 1mol/L 的 NaOH 溶液10 mL,再稀释成 100 m L,再从中取出 10 mL,这 10 mL 溶液的物质的量浓度为________。
(5)取配制的1mol/L 的 NaOH 溶液10 mL,加入足量的氧化铝充分反应(溶液体积保持不变),得到的溶液的浓度为_____________,发生反应的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com