
����Ŀ��̼�Ȼ�ԭ���㷺���ںϽ��ϵ��Ʊ����ش��������⣺
(1)һ���Ʊ����������ķ�Ӧԭ��Ϊ23Al2O3+15C+5N2==2Al23O27N5+15CO������Al23O27N5�е��Ļ��ϼ�Ϊ______________________________��
(2)���̼��ұ���������ܶ෴Ӧ�����е�������Ӧ���£�
Al2O3 (s)+3C(s)==Al2OC(s)+2CO(g)��H1
2Al2OC(s)+3C(s)==Al4C3(s)+2CO(g)��H2
2Al2O3 (s)+9C(s)== Al4C3 (s)+6CO(g)��H3
�١�H3=_________(�á�H1����H2��ʾ)��
��Al4C3�����������ᷴӦ�Ʊ�һ����������÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��(3)������̼�Ȼ�ԭ���̺Ͻ��������Ӧ��CO��CO2ƽ���ѹ�ȵ���Ȼ����ֵ(1nK=2.303lgK)���¶ȵĹ�ϵ��ͼ��ʾ(��֪Kp����ƽ���ѹ����Ũ�ȼ������õ�ƽ�ⳣ������ѹ=��ѹ����������ʵ�������)��

I.Mn3C(s)+4CO2(g) ![]() 3MnO(s)+5CO(g)Kp(I)
3MnO(s)+5CO(g)Kp(I)
II.Mn(s)+CO2(g) ![]() MnO(s)+CO(g) Kp(II)
MnO(s)+CO(g) Kp(II)
III.Mn3C(s)+CO2(g) ![]() 3Mn(s)+2CO(g)Kp(III)
3Mn(s)+2CO(g)Kp(III)
�١�H>0�ķ�Ӧ��__________________(�I����II����I��)��
��1200Kʱ����һ���Ϊ2L�ĺ����ܱ���������17.7gMn3C(s)��0.4molCO2��ֻ������ӦI��5min��ﵽƽ�⣬��ʱCO��Ũ��Ϊ0.125mol/L����0~5min��V(CO2)=____________��
����һ����ɱ���ܱ������м���һ������Mn(s)������һ������CO2(g)��ֻ������ӦII��������˵����ӦII�ﵽƽ�����____________(����ĸ)��
A.������������ٸı� B.������������ٸı� C.��������������ٸı�
��������ܱ������м���Mn3C������0.1molCO2����ֻ������ӦIII������A�㷴Ӧ�ﵽƽ�⡣����������ѹΪakPaʱ��CO2��ת����Ϊ______________��A���Ӧ�¶��µ�Kp(III)=____________��
���𰸡���3 2��H1+��H2 Al4C3+12HCl==4AlCl3+3CH4�� III 0.02mol��L-1��min-1 BC 33.3% 0.5akPa
��������
��1�����ݻ��ϼ۷���ȷ����Ԫ�ػ��ϼۣ�(2)���ݸ�˹���ɽ��С�H3�ļ��㣬���������Ϊ���鼰ԭ���غ������д����ʽ��(3) �����¶ȣ�1nK������K����ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����ӦIII���ϣ���ӦII: Mn(s)+CO2(g) ![]() MnO(s)+CO(g)Ϊ�����������ķ��ȷ�Ӧ�����ݡ����������ƽ�⡱�����жϣ���4������������ܱ������м���Mn3C������0.1molCO2����ֻ������ӦIII������A�㷴Ӧ�ﵽƽ�⣬
MnO(s)+CO(g)Ϊ�����������ķ��ȷ�Ӧ�����ݡ����������ƽ�⡱�����жϣ���4������������ܱ������м���Mn3C������0.1molCO2����ֻ������ӦIII������A�㷴Ӧ�ﵽƽ�⣬![]() ����c(CO)=1/2c(CO2)���н�����
����c(CO)=1/2c(CO2)�������
(1)���ݻ��ϼ۷�����Ϊ+3�ۣ���Ϊ-2�ۣ����Ļ��ϼ�Ϊ-3����ȷ�𰸣�-3��
(2) �ٸ��ݸ�˹���ɣ���Ӧ����2+��Ӧ�ڣ��ɵ�2Al2O3 (s)+9C(s)== Al4C3 (s)+6CO(g)��H3=2��H1+��H2����ȷ�𰸣�2��H1+��H2��
�������Ϊ���飬Al4C3�����������ᷴӦ���ɼ�����Ȼ�������Ӧ�Ļ�ѧ����ʽΪ��Al4C3+12HCl==4AlCl3+3CH4������ȷ�𰸣�Al4C3+12HCl==4AlCl3+3CH4����
(3)����ͼ����Ϣ��֪����ӦIII�����¶ȣ�1nK������K����ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����H>0����ȷ�𰸣�III��
��0~5min��V(CO2)=4/5��![]() =0.02mol��L-1��min-1 ����ȷ����0.02mol��L-1��min-1��
=0.02mol��L-1��min-1 ����ȷ����0.02mol��L-1��min-1��
�۷�ӦII: Mn(s)+CO2(g) ![]() MnO(s)+CO(g)Ϊ�����������ķ��ȷ�Ӧ�����ݱ��������ƽ������жϣ�A.��ӦΪ���岻��ķ�Ӧ����Ӧ��������������DZ�����������Ϊƽ��״̬�����ݣ�A����ӦΪ������������ķ�Ӧ�����������Ϊ��������������������ٸı�ʱ����Ӧ�ﵽƽ��״̬��B��ȷ����Ӧ��һ������������С�ķ�Ӧ�������������Ϊ����������������������ٸı�ʱ����Ӧ�ﵽƽ��״̬��C��ȷ����ȷѡ��BC ��
MnO(s)+CO(g)Ϊ�����������ķ��ȷ�Ӧ�����ݱ��������ƽ������жϣ�A.��ӦΪ���岻��ķ�Ӧ����Ӧ��������������DZ�����������Ϊƽ��״̬�����ݣ�A����ӦΪ������������ķ�Ӧ�����������Ϊ��������������������ٸı�ʱ����Ӧ�ﵽƽ��״̬��B��ȷ����Ӧ��һ������������С�ķ�Ӧ�������������Ϊ����������������������ٸı�ʱ����Ӧ�ﵽƽ��״̬��C��ȷ����ȷѡ��BC ��
��������ܱ������м���Mn3C������0.1molCO2����ֻ������ӦIII������A�㷴Ӧ�ﵽƽ�⣬![]() ����c(CO)=1/2c(CO2),����������ѹΪakPaʱ��CO2��ת����Ϊ0.5/(1+0.5)��100%=33.3% , A���Ӧ�¶��µ�Kp(III)=P(CO)/p(CO2)=0.5akPa����ȷ�𰸣�33.3% ��0.5akPa��
����c(CO)=1/2c(CO2),����������ѹΪakPaʱ��CO2��ת����Ϊ0.5/(1+0.5)��100%=33.3% , A���Ӧ�¶��µ�Kp(III)=P(CO)/p(CO2)=0.5akPa����ȷ�𰸣�33.3% ��0.5akPa��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���鼰�仯�����ڹ�ҵ��������;�㷺��ij�о�С���ø�ѡ���Ļ������Ҫ�ɷ���Bi2S3����������SiO2�����ʣ��Ʊ�NaBiO3�����������£�

��֪��ˮ��������Bi3+��Fe3+��
�ش��������⣺
��1������ȡ��ʱ��Ϊ����߽�ȡ���ʣ��ɲ�ȡ�Ĵ�ʩ��______����дһ����������1����������Ҫ�ɷ���______���ѧʽ����
��2����ȡʱ�������Ũ�����Ŀ����______����ĸҺ����ͨ������X���ѭ�����ã�����XΪ______�������ƣ���
��3��д������ʱ���������ƵĻ�ѧ����ʽ______�������ı�״����4.48 L O2ʱ��ת�Ƶ��ӵ���Ŀ��______��
��4��25��ʱ����Ũ�Ⱦ�Ϊ0.04 mol��L��1��Cu2����Pb2����Bi3���Ļ����Һ�еμ�(NH4)2S��Һ������Һ�������1��������c(Pb2+)=10-5 mol��L-1ʱǡ����ȫ������������Һ��c(Cu2+)��c(Bi3+)��______��[��֪��Ksp(CuS)��6.0��10��36��Ksp(PbS)��3.0��10��28��Ksp(Bi2S3)��1.6��10��20]
��5����˫����(H2Dz����Ԫ���ᣩ��CC14�����ȡ���ɴӹ�ҵ��ˮ����ȡ�������ӣ�H2Dz�Ƚ�����������ϳɵ����Ե�����[��Cu(HDz)2��]������CCl4��ȡ��������ͼ��������������������Hg2+��Bi3+��Zn2+�ķ�ˮʱ��������ߣ�E%��ʾ�����������������ʽ����ȡ����İٷ��ʣ���
�ٵ�����pH��2.5ʱ���飨Bi���Ĵ�����ʽ��______��
������ȡ���CCl4�м���NaOH��Һ�ɽ���Ԫ���������������ʽ������������Ӧ�����ӷ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���ò���һ��������ͬ���칹�����
A. �����ϩ�루![]() �������ʵ�����Br2��Ӧ
�������ʵ�����Br2��Ӧ
B. 2-�ȶ����루![]() ��NaOH�Ҵ���Һ����
��NaOH�Ҵ���Һ����
C. �ױ���Cl2��һ�������·���ȡ����Ӧ
D. ���ǻ������ᣨ![]() ����NaHCO3��Һ��Ӧ
����NaHCO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pKa=-lgKa��25��ʱ��H2SO3��pKa1=1.85��pKa2=7.19����0.1000molL-1NaOH��Һ�ζ�20.00mL0.1000molL-1H2SO3��Һ�����е�pH�仯��ͼ��ʾ������˵���������
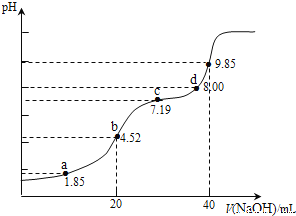
A. a��������Һ�У�3c(H2SO3)+3c(HSO3-)+3c(SO32-)=0.2000molL-1
B. b��������Һ�У�c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c��������Һ�У�c(SO32-)=c(HSO3)
D. d��������Һ�У�c(Na+)��c(SO32-)��c(HSO3-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����HCl��AlCl3�����Һ����μ���NaOH��Һ�����ɳ���������NaOH��Һ�������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ���������ǣ� ��

A. M���Ӧ����Һ�У�K+��Fe2+��SO42-��NO3-
B. N���Ӧ����Һ�У�K+��NH4+��Cl-��CO32-
C. S���Ӧ����Һ�У�Na+��SO42-��HCO3-��NO3-
D. R���Ӧ����Һ�У�Na+��SO42-��Cl-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ绯ѧԭ����ԭCO2��ȡZnC2O4��װ����ͼ��ʾ(���Һ���μӷ�Ӧ)������˵����ȷ����

A. ����H2SO4��Һ�����Һ
B. �����ӽ��QĤ����Ҫ�����lj���������
C. Pb�缫�ĵ缫��Ӧʽ��2CO2-2e-==C2O42-
D. ������·�К�����0.02mol���ӣ�Zn�缫��������0.65g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�ķ���ʽ����ȷ����
A. Na2Sˮ��Һ�ʼ��ԣ�S2-+2H2O![]() H2S+2OH��
H2S+2OH��
B. 0.1 mol��L-1 ��ˮ��pHΪ11��NH3��H2O![]() NH4��+ OH��
NH4��+ OH��
C. Al2S3��ˮ��Һ�в����ڣ�Al2S3+6H2O === 2Al(OH)3��+3H2S��
D. MgO����ϡ�����У�MgO+2H��===Mg2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����ˡ�������2016��ʮ���¼���֮һ��̼������أ����ԭ����ͼ��ʾ����֪��������Al2(C2O4)3��������ˮ���������й�˵����ȷ����
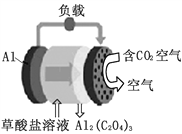
A. ��װ�ý�����ת��Ϊ��ѧ��
B. �����ĵ缫��ӦΪC2O42��-2e-===2CO2
C. ÿ����1molAl2(C2O4)3����6mol������������
D. ��������Һ�е�����������Al�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����10 mLŨ��Ϊ0.01mol/L�İ�ˮ��Һ����μ���0.01mol/L��CH3COOH��Һ�����Һ��pH �����CH3COOH �����V֮��ı仯��������ͼ��ʾ������˵����ȷ����
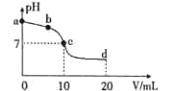
A. a����Һ��pH=12
B. b��ʱc(CH3COO-)>c(NH4+)
C. c��ʱˮ�ĵ���̶����
D. d�㴦�������:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3��H2O)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com