
2- 4 |
| n |
| V |
| n |
| c |
| 6.5g |
| 65g/mol |
| 0.1mol×22.4L |
| 1mol |
| 0.1mol×1mol |
| 1mol |
| 0.1mol |
| 0.1L |
| 0.4mol |
| 1mol/L |


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| A、124g P4含有的P-P键的个数为4NA |
| B、12g石墨中含有C-C键的个数为1.5NA |
| C、12g金刚石中含有C-C键的个数为2NA |
| D、60g SiO2中含Si-O键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的醋酸钠溶液20 mL与0.1mol?L-1盐酸10 mL混合后溶液显酸性c (CH3COO-)>c (Cl-)>c (CH3COOH)>c (H+) | ||||
B、pH=7的NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO
| ||||
| C、已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F一)]<[c(K+)-c(CH3COO-)] | ||||
| D、已知某温度下Ksp(CH3COOAg)=2.8×10-3,浓度均为0.1 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 正极 | Zn | Cu | Zn | 石墨 |
| 负极 | Cu | Zn | Ag | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
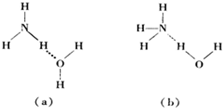 按要求填空
按要求填空查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com