
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前________和________是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-,NO2-和CN-等有毒有害的 还原性离子氧化除去。请写出CiO2将废水中剧毒的CN^氧化成无毒气体的离子方程式: ________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交換的CaR2 (或MgR2 )型树脂置于________中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,下面是海水利用电渗析法获得淡水的原理图,已知 海水中含有Na+、Cl-、 Ca2+、 Mg2+、SO42-等离子,电极为惰性电极。请回答:
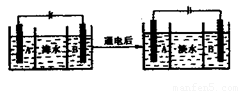
①阳离子交换膜是指________(填“ A”或“B”)。
②写出通电后阳极区的电极反应式________________。
(8分)(1)离子交换法(1分);膜分离法(1分) (2)2CN-+2ClO2=2CO2↑+N2↑+2Cl-(2分)
(3)软化(1分);盐酸或酸(1分) (4)①B(1分) ②2Cl――2e-=Cl2↑(1分)
【解析】
试题分析:(1)水处理技术的核心是减少或除去水中的各种杂质离子,主要的去离子方法是离子交换法和膜分离法。
(2)ClO2氧化性较强,是常用的氧化剂,其中+4价氯元素通常被还原为-1价。在该反应中而CN-中+2价碳元素通常被氧化成+4价,而氮元素则容易被还原成0价形成氮气,所以该反应等离子方程式是2CN-+2ClO2=2CO2↑+N2↑+2Cl-。
(3)地下水硬度较大,需要软化,所以自来水厂需要对地下水进行软化,阳离子交换树脂(HR)可以实现阳离子之间的交换,阴离子交换树脂交换出H+,生成CaR2(或MgR2),可用盐酸或酸溶液使阴离子交换树脂再生。
(4)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,电解池阴极是阳离子放电,所以隔膜B是阳离子交换膜。
②电解池阳极是溶液中的氯离子放电,所以通电后阳极电极反应式是2Cl――2e-=Cl2↑。
考点:考查水的净化、污水处理、硬水软化、氧化还原反应的有关判断以及电极反应式的书写等


科目:高中化学 来源: 题型:
 (2013?泰安二模)处理主要包括水的净化、污水处理、硬水软化和海水淡化等.
(2013?泰安二模)处理主要包括水的净化、污水处理、硬水软化和海水淡化等.查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省开封市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:

①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:选择题
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,______________________和是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式______________________________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行____________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______________中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是利用电渗析法由海水获得淡水的原理图。已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。
①阳离子交换膜是指_______________(填“A”或“B”);
②写出通电后阳极区的电极反应式____________。

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 处理主要包括水的净化、污水处理、硬水软化和海水淡化等.
处理主要包括水的净化、污水处理、硬水软化和海水淡化等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com