
【题目】根据题意解答
(1)CH3﹣CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
化学键 | C﹣H | C=C | C﹣C | H﹣H |
键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热△H= .
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S) . 已知断裂下列化学键需要吸收的能量分别为如下
化学键 | P﹣P | P﹣O | P=O | O﹣O | O=O |
键能(kJ/mol) | a | b | c | d | e |
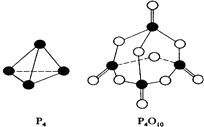
根据图示的分子结构和有关数据估算该反应的△H=;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气. 已知:①N2(g)+2O2(g)=N2O4(1)△H1=﹣195.0kJmol﹣1
②N2H4(1)+O2(g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式 .
【答案】
(1)+125kJ/mol
(2)819kJ?mol﹣1
(3)2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol
【解析】解:(1)在反应CH3﹣CH3→CH2=CH2+H2中,断裂6mol C﹣H键,1mol C﹣C键共吸收的能量为:6×414kJ+347kJ=2831kJ,生成1molCH2=CH2和1molH2 , 共形成4molC﹣H键,1molC=C、1molH﹣H,共放出的能量为:4×414kJ+615kJ+435kJ=2706kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2831kJ﹣2706kJ=125,所以反应热为+125kJ/mol,所以答案是:+125 kJ/mol.(2)白磷燃烧生成P4O6的热化学方程式为P4(s)+3O2(g)=P4O6(s);△H=6×198kkJ/mol+3×498kJ/mol﹣12×360kJ/mol=﹣1638kJ/mol,则0.5mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为0.5mol×1638kJ/mol=819kJ,所以答案是:819kJmol﹣1 . (3)①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1根据盖斯定律写出肼和N2O4反应的热化学方程:②×2﹣①得到:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol;
所以答案是:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol.
【考点精析】本题主要考查了反应热和焓变的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热才能正确解答此题.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2﹣的物质的量浓度的对数. 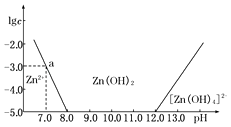
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为 .
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp= .
(3)某废液中含Zn2+ , 为提取Zn2+可以控制溶液中pH的范围是 . 某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁.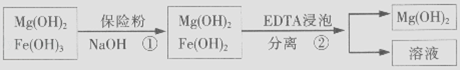
(4)步骤①中加入保险粉(Na2S2O4)的作用:
(5)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应.虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2 . 请从沉淀溶解平衡的角度加以解释;
(6)为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如表:
精制阻燃剂的条件 | 阻燃剂铁含量 | |||
序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10﹣4g) |
1 | 40 | 0.05 | 0.05 | 7.63 |
2 | 40 | 0.05 | 0.10 | 6.83 |
3 | 60 | 0.05 | 0.10 | 6.83 |
4 | 60 | 0.10 | 0.10 | 6.51 |
若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是(填字母).
①40℃②60℃③EDTA质量为O.05g ④EDTA质量为0.10g ⑤保险粉质量为0.05g⑥保险粉质量为0.10g
A.①③⑤
B.②④⑥
C.①④⑥
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠投入滴有石蕊的水中,下列现象叙述错误的是( )
A. 水溶液变为红色 B. 钠熔成闪亮的小球并在水面四处游动
C. 钠浮在水面 D. 有气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中充入2molNO2 , 一定温度下建立如下平衡:2NO2 ![]() N2O4 , 此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4 , 在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是( )
N2O4 , 此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4 , 在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是( )
A.x>y
B.x<y
C.x=y
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如下装置制取和验证SO2的性质。

请回答:
(1)写出图中仪器的名称:a___________,b___________。
(2)棉球中NaOH溶液的作用是______________________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_____________________。
A.紫色石蕊试液 B.无色酚酞试液 C.澄清石灰水 D.碘水
(4)下列说法正确的是____________。
A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B.先向装置中加入试剂(药品),再进行气密性检查
C.实验开始后,洗气瓶①和③只溶液均褪色,两者均可证明SO2具有漂白性
D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
(5)洗气瓶④中发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCO和1molH2O充入容器中,在催化剂存在下发生反应H2O (g)+CO(g)H2 (g)+CO2(g)达到平衡时,发现有50%的CO转化为CO2 . 在其他条件不变的情况下,若将1molCO和3molH2O充入反应器中,则反应达平衡后,求:
(1)达平衡后CO的转化率
(2)混合气体中CO2体积分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按照要求完成下列方程式。
(1)工业制取氯气的离子反应方程式:________________________________________。
(2)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:______________________________________。
(3)澄清石灰水中通入CO2变浑浊又变澄清的反应方程式:__________________________________________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 可利用过滤的方法分离胶体和溶液
B. 胶体中分散质粒子直径大小在1~100nm之间
C. 可以利用丁达尔效应区分胶体和溶液
D. 胶体在一定条件下能稳定存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com