
����Ŀ����ͼ��ʾ��������Ϊ��Һ��pH��������ΪZn2+��[Zn��OH��4]2�������ʵ���Ũ�ȵĶ����� 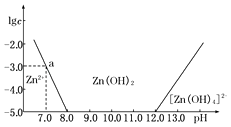
�ش��������⣺
��1����ZnCl2��Һ�м�������������������Һ����Ӧ�����ӷ���ʽ�ɱ�ʾΪ ��
��2����ͼ�����ݼ���ɵ�Zn��OH��2���ܶȻ�Ksp= ��
��3��ij��Һ�к�Zn2+ �� Ϊ��ȡZn2+���Կ�����Һ��pH�ķ�Χ�� �� ij��������ˮ���Ȼ�þ�ʹ�ʯ����ȡ��������þ�������������������ʣ�ͨ���������̽����ᴿ���ƣ������ȼ��������þ��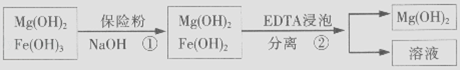
��4��������м��뱣�շۣ�Na2S2O4�������ã�
��5����֪EDTAֻ������Һ�е�Fe2+��Ӧ����������ˮ�����ʣ�����Mg��OH��2��Ӧ����ȻFe��OH��2������ˮ���������������EDTA�ļ��룬�����ܹ���Fe��OH��2��ȥ����ô��ȸߵ�Mg��OH��2 �� ��ӳ����ܽ�ƽ��ĽǶȼ��Խ�����
��6��Ϊ�о���ͬ�����ᴿ���������Ƶ���ȼ���Ĵ��ȴӶ�ȷ������ᴿ������ij�о�С���ȡ������������4���������Ƶõ���ȼ�����к������IJⶨ����������
������ȼ�������� | ��ȼ�������� | |||
��� | �ᴿ��ϵ�¶�/�� | ����EDTA����/g | ���뱣�շ�����/g | W��Fe��/��10��4g�� |
1 | 40 | 0.05 | 0.05 | 7.63 |
2 | 40 | 0.05 | 0.10 | 6.83 |
3 | 60 | 0.05 | 0.10 | 6.83 |
4 | 60 | 0.10 | 0.10 | 6.51 |
�����������������������ϱ����ݣ���ȡ�ߴ�����ȼ�����������������ĸ����
��40���60���EDTA����ΪO.05g ��EDTA����Ϊ0.10g �ݱ��շ�����Ϊ0.05g�ޱ��շ�����Ϊ0.10g
A.�٢ۢ�
B.�ڢܢ�
C.�٢ܢ�
D.�ڢ�
���𰸡�
��1��Zn2++4OH���T[Zn��OH��4]2��
��2��1.00��10��17
��3��8.0��pH��12.0
��4��������������ԭΪ����������
��5��Fe��OH��2����Һ�д�������ƽ�⣺Fe��OH��2��s��=Fe2+��aq��+2OH����aq�������ϵ���EDTAʱ��EDTA�����Fe 2+��ʹƽ�������ƶ���ʹFe��OH��2�����ܽ�
��6��C
���������⣺��1����ͼ���֪��Һ�ļ��Խ�ǿʱ��п�Ĵ�����ʽΪ[Zn��OH��4]2�� �� �����䷴Ӧ�����ӷ���ʽΪ��Zn2++4OH���T[Zn��OH��4]2�� �� ���Դ��ǣ�Zn2++4OH���T[Zn��OH��4]2������2������Һ��pH=7.0ʱ��c��Zn2+��=10��3molL��1 �� Ksp=c��Zn2+����c2��OH����=10��3��10��7��2=10��17 ��
���Դ��ǣ�1.00��10��17�� ��3������ͼ��֪����Һ��pH��ΧΪ8��pH��12ʱ��Zn2+�ɽ�Zn2+ת��ΪZn��OH��2��������Һ��п����Ũ��С��10��5 molL��1 �� ���Խ�����Ϊп���Ӳ����ڣ�����ij��Һ�к�Zn2+���ӣ�Ϊ��ȡZn2+���ӿ��Կ�����Һ��pHֵ�ķ�Χ��8.0��pH��12.0��
���Դ��ǣ�8.0��pH��12.0����4�����շۣ�Na2S2O4�����Խ�����������ԭΪ���������������������ӷ���ʽΪ��6Fe��OH��3+S2O42��+2OH��=6Fe��OH��2+2SO42��+4H2O��
���Դ��ǣ�������������ԭΪ��������������5��Fe��OH��2����Һ�д�������ƽ�⣺Fe��OH��2��s��=Fe2+��aq��+2OH����aq�������ϵ���EDTAʱ��EDTA�����Fe 2+��ʹƽ�������ƶ���ʹFe��OH��2�����ܽ⣬
���Դ��ǣ�Fe��OH��2����Һ�д�������ƽ�⣺Fe��OH��2��s��=Fe2+��aq��+2OH����aq�������ϵ���EDTAʱ��EDTA�����Fe 2+��ʹƽ�������ƶ���ʹFe��OH��2�����ܽ⣻��6���۲�ʵ��2��3֪������������ͬʱ���¶Ȳ�ͬ����������ͬ����ȡ����������������þ���ܽ⣬���Բ��õ��½Ϻã�ѡ40�棬�۲�ʵ��3��4֪������������ͬʱ��EDTA����Խ������Խ�ͣ�����ѡȡEDTA����Ϊ0.10g���۲�ʵ��1��2֪������������ͬʱ�����շ�����Խ������Խ�ͣ�����ѡȡ���շ�����Ϊ0.10g
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�ͬ��������嵥��X2�����嵥��Y2��������Z����������䣬��Z�Ļ�ѧʽΪ
A.X2Y2B.XYC.XY2D.X2Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӺ�������ȡ��IJ��������е�����ѡ�ò���ȷ���ǣ� ��
A.��ȡ3g���ҵĸɺ�������������ƽ
B.���ոɺ�������ȫ��ɻҽ�����������
C.������к�ĺ����Һ�ˮ�Ļ��������©��
D.�����Ȼ�̼��������ĺ����ҽ�ȡҺ����ȡ�ⵥ��������Һ©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. CO��C2H4��Ħ����������28g B. 18gˮ�к���1 molˮ����
C. O2����Է���������32 g��mol-1 D. l molNO��������30 g��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѻ�����狀�����淋Ļ��Һa L�ֳ����ȷݣ�һ�ݼ��뺬b mol NaOH����Һ�����ȣ�ǡ�ð�NH3ȫ���ϳ�����һ��������c mol BaCl2����ʹSO42����ȫ��������ԭ��Һ��NO3�������ʵ���Ũ��Ϊ��������
A.![]()
B.![]()
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ�����X��������ѧ��ѧ�г��������ʣ���ת����ϵ��ͼ�����X�������ǣ�������
A.��ΪC��X��O2
B.��ΪSO2 �� X��NaOH��Һ
C.��ΪCl2 �� XΪFe
D.��ΪAl��XΪNaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��Ӧ��Ӧ��ͼ����ȷ���ǣ�������
A.
25��ʱ������������Һ��ͨ������
B.
��NaAlO2��Һ��ͨ��HCl����
C.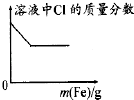
�������Ȼ�����Һ�м�������
D.
��BaSO4������Һ�м���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1��CH3��CH3��g����CH2=CH2��g��+H2��g�����йػ�ѧ���ļ������£�
��ѧ�� | C��H | C=C | C��C | H��H |
���ܣ�kJ/mol�� | 414.4 | 615.3 | 347.4 | 435.3 |
�Լ���÷�Ӧ�ķ�Ӧ�ȡ�H= ��
��2�����������ɷ������·�Ӧ��P4��S��+5O2��g��=P4O10��S�� �� ��֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ����
��ѧ�� | P��P | P��O | P=O | O��O | O=O |
���ܣ�kJ/mol�� | a | b | c | d | e |
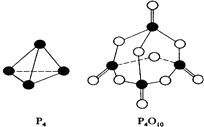
����ͼʾ�ķ��ӽṹ���й����ݹ���÷�Ӧ�ġ�H=��
��3���¿���Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������ ��֪����N2��g��+2O2��g��=N2O4��1����H1=��195.0kJmol��1
��N2H4��1��+O2��g��=N2��g��+2H2O��g����H2=��534.2kJmol��1
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com